คู่กรด - เบส
| ความแรงของกรดและเบส
รู้ไหมว่ากรด-เบส
นี้มีคู่ด้วยนะเรียกว่า คู่กรด-เบส จะเป็นอย่างไรนั้นเดี๋ยวจะอธิบายต่อไป
จากปฏิกิริยาของกรดกับเบสที่กล่าวถึงแล้ว
ตามทฤษฎีของเบรินสเตต-
ลาวรี จะเห็นว่าในปฏิกิริยาหนึ่งๆ
อาจจะจัดคู่กรด-
เบสได้ 2 คู่ด้วยกัน
ตัวอย่างเช่น
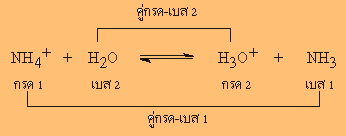
ปฏิกิริยาตัวอย่างนี้
ปฏิกิริยาไปข้างหน้า
NH4+ ทำหน้าที่เป็นกรด
เพราะให้ H+
กับ H2O แล้วได้เป็น
NH3และ H2O รับ
H+ ทำหน้าที่เป็นเบส
ส่วนปฏิกิริยาย้อนกลับ
H3O+ เป็นกรด
เพราะให้ H+
กับ NH3 ซึ่งเป็นเบส
แล้วได้ H2O
และ NH4+ ตามลำดับ
เรียก NH4+
ว่าคู่กรดของ
NH3 ( เบส)
H2O ว่าคู่เบสของ
H3O+ ( กรด)
NH3 ว่าคู่เบสของ
NH4+ (กรด)
H3O+ ว่าคู่กรดของ
H2O ( กรด)
จะเห็นได้ว่า
คู่กรด- เบสนั้นจะมีจำนวนโปรตอน
(H) ต่างกัน 1 ตัว
หรืออาจกล่าวได้ว่า
จำนวนโปรตอนของคู่กรด
จะมากกว่าโปรตอนคู่เบสอยู่
1 ตัวเสมอ
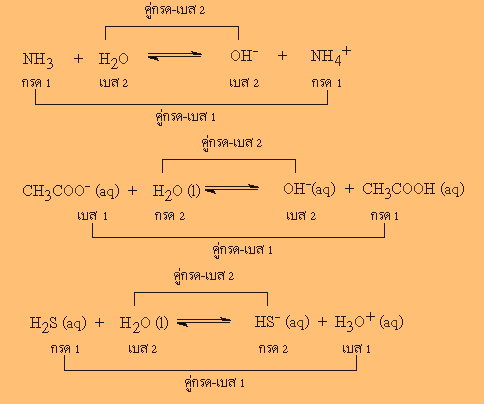
ตัวอย่าง คู่กรด
- เบส
::กลับด้านบน::
ความแรงของกรดและเบส
การเปรียบเทียบความแรงของกรดและเบส
อาจจะพิจารณาได้ดังนี้
1. ดูจากการแตกตัวของกรด
กรดที่มีการแตกตัวมาก
มีความเป็นกรดมาก
กรดและเบสที่แตกตัวได้
100% จะเรียกว่ากรดแก่
และเบสแก่
ตามลำดับ ซึ่งสามารถนำไฟฟ้าได้ดี
แต่ถ้ากรดและเบสนั้นแตกตัวได้เพียงบางส่วนก็จะเรียกว่า
กรดอ่อน หรือเบสอ่อน
ตามลำดับ ซึ่งการนำไฟฟ้าจะไม่ดี
สำหรับการพิจารณาค่าการแตกตัวของกรดและเบสนั้น
นอกจากจะคิดจากเปอร์เซ็นต์การแตกตัว
หรืออาจจะดูได้จากค่าคงที่สมดุลของการแตกตัวของกรดหรือเบส
(Ka หรือ Kb) เช่น
ความแรงของเบส
พิจารณาจากค่า
Kb กล่าวคือ
ถ้ามีค่า Kb
มาก มีความเป็นเบสมากกว่า
Kb น้อย เช่น
NH3 Kb = 1.76 x 10-5
N2H4 Kb = 9.5 x 10-7
C 6H5NH2 Kb = 4.3
x 10 -10
ความเป็นเบส
NH3> N2H4 > C6H5NH2
2. ดูจากความสามารถในการให้และรับโปรตอน
กรดแก่ ได้แก่
กรดที่ให้โปรตอนได้มาก
กรดอ่อน ได้แก่
กรดที่ให้โปรตอนได้น้อย
เบสแก่ ได้แก่
เบสที่รับโปรตอนได้มาก
เบสอ่อน ได้แก่
เบสที่รับโปรตอนได้น้อย
โดยมีข้อสังเกตเกี่ยวกับคู่กรด-
เบส ดังนี้
- ถ้ากรดเป็นกรดแก่
คู่เบสจะเป็นเบสอ่อน
เช่น
HCl (aq) + H2O  H3O+ (aq)
+ Cl- (aq) H3O+ (aq)
+ Cl- (aq)
กรดแก่ เบสอ่อน
- ถ้ากรดเป็นกรดอ่อน
คู่เบสจะเป็นเบสแก่
เช่น
HS- (aq) + H2O  H3O+ + S2- (aq)
H3O+ + S2- (aq)
กรดอ่อน เบสแก่
- ถ้าเบสเป็นเบสแก่
คู่กรดจะเป็น
กรดอ่อน เช่น
H3O+ + S2-(aq)  HS- (aq) + H2O
HS- (aq) + H2O
เบสแก่ กรดอ่อน
- ถ้าเบสเป็นเบสอ่อน
คู่กรดจะเป็น
กรดแก่ เช่น
Cl-(aq) + H3O+  HCl + H2O
HCl + H2O
เบสอ่อน กรดแก่
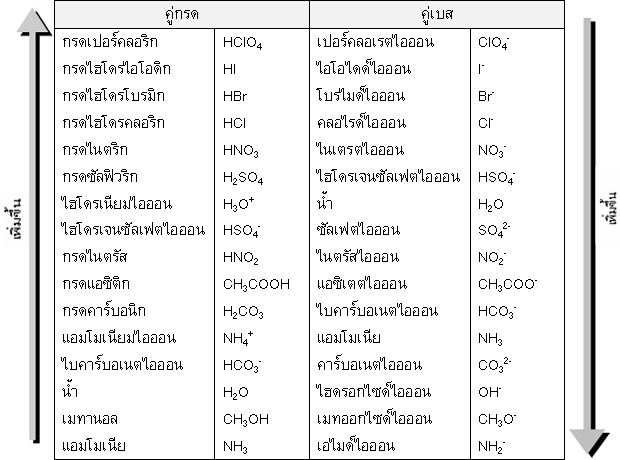
ตารางลำดับความแรงของกรดและเบสตัวอย่างตามทฤษฎีของเบรินสเตต-
ลาวรี
3. ดูจากการเรียงลำดับในตารางธาตุ
การพิจารณาความแรงของกรดและเบสดูจากการเรียงลำดับของธาตุที่อยู่ในกรดนั้้้น
ตามตารางธาตุ
ซึ่งแบ่งออกได้เป็น
3.1 กรดออกซี
หมายถึง กรดที่ประกอบด้วย
H, O และธาตุอื่นอีก
เช่น HNO3 ,H3PO4,H3AsO4
,HClO4 ถ้าจำนวนอะตอมออกซิเจนเท่ากัน
ความแรงของกรดเรียงลำดับดังนี้
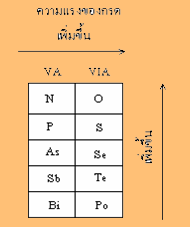
ดังนั้น H2SO4
> H2SeO4 , H3PO4
> H3AsO4
3.2 กรดที่ไม่มีออกซิเจน
เช่น HCl, HBr, HF, และ
HI ความแรงของกรดแรงลำดับดังนี้
HI > HBr > HCl > HF
H2S > H2O
::กลับด้านบน::
|



