การแตกตัวของกรดแก่และเบสแก่
| การแตกตัวของกรดอ่อน
| การแตกตัวของกรดมอนอโปรติก
การแตกตัวของกรดพอลิโปรติก
| ค่าคงที่สมดุลของกรดอ่อน
| การแตกตัวของเบสอ่อน
การแตกตัวของกรดแก่และเบสแก่
การแตกตัวของกรดแก่และเบสแก่
จะแตกตัวได้หมด
100% หมายถึง การแตกตัวของกรดแก่และเบสแก่
เป็นไอออนได้หมดในตัวทำละลายซึ่งส่วนใหญ่เป็นน้ำ
เช่น การแตกตัวของกรด
HCl จะได้ H+ หรือ
H3O+ และ Cl-ไม่มี
HCl เหลืออยู่
หรือการแตกตัวของเบส
เช่น NaOH ได้ Na+
และ OH- ไม่มี
NaOH เหลืออยู่
การแตกตัวของกรดแก่และเบสแก่เขียนแทนด้วยลูกศร
«Öè§แสดงการเปÅÕèี่ยนแปลงไปข้างหน้าเพียงอย่างเดียว
เช่น
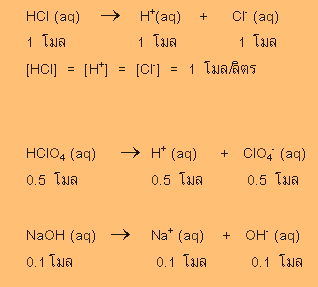
การคำนวณเกี่ยวกับการแตกตัวของกรดแก่และเบสแก่
ตัวอย่าง·Õè
1 จงคำนวณหา
[H3O+] , [NO3-] ในสารละลาย
0.015 M HNO3
วิธีทำ
HNO3 +H2O  H3O+
+ NO3- H3O+
+ NO3-
0.015
เพราะฉะ¹Ñé¹ [H3O+]
= [NO3-] = 0.015 โมล/
ลิตร
ตัวอย่าง·Õè
2 ถ้า KOH 0.1 โมล
ละลาย¹éÓและสารละลายมีปริมาตร
2 ลิตร ในสารละลายจะมีไอออนใดบ้างอย่างละ¡Õèี่โมลต่อลิตร
วิธีทำ
KOH (s) 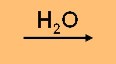 K+
(aq) + OH- (aq) K+
(aq) + OH- (aq)
0.1โมล/ 2 ลิตร
สารละลาย KOH
2 ลิตร มี KOH 0.1 โมล
สารละลาย KOH
1 ลิตร มี KOH 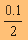 = 0.05 โมล/ ลิตร
= 0.05 โมล/ ลิตร
ดังนั้น KOH จะแตกตัวให้
K+ และ OH- อย่างละ
0.05 โมล/ ลิตร
ตัวอย่าง·Õè
3 สารละลายกรดแก่
(HA) 250 ลูกบาศก์เซนติเมตร
มีปริมาณ H3O+
ไอออน 0.05 โมล
สารละลาย¹Õéี้มีความเข้มข้นเท่าใด
ถ้าเติมกรด¹Õéี้ลงไปอีก
0.2 โมล โดย·Õèี่สารละลายมีปริมาตรคงเดิม
สารละลาย·Õèี่ได้จะมีความเข้มข้นเท่าใด
วิธีทำ
HA 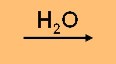 H3O+
(aq) + A- (aq) H3O+
(aq) + A- (aq)
0.05
โมล/ 250 cm3
สารละลาย HA
250 cm3 มี HA 0.05 โมล
สารละลาย HA
1000 cm3 มี HA =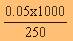 = 0.20 โมล
= 0.20 โมล
เพราะ©Ð¹Ñé¹สารละลายที่ได้มีความเข้มข้น
0.20 โมล/ ลิตร
ถ้าเติมกรดอีก
0.2 โมล
สารละลายมี
HA รวม·Ñé§หมด = 0.05 + 0.2
= 0.25 โมล
สารละลาย HA
250 cm3มี HA 0.25 โมล
สารละลาย HA
1000 cm3 มี HA = 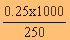 = 1.00 โมล
= 1.00 โมล
เพราะ©Ð¹Ñé¹สารละลายที่ได้มีความเข้มข้น
1.00 โมล/ ลิตร
ตัวอย่าง·Õè
4 จงหาความเข้มข้นของ
OH- ·Õèี่เกิดจากการเอา
NaOH 10.0 กรัม ละลายใน¹éÓทำเป็นสารละลาย
0.2 dm3 (Na = 23, O = 16, H = 1)
วิธีทำ
จำนวนโมลของ
NaOH = 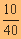 = 0.25
mol = 0.25
mol
สารละลาย 0.2
dm3 มีà¹×éÍของ NaOH =
0.25 โมล
สารละลาย 1 dm
3มี NaOH = 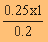 = 1.25 โมล/ ลิตร
= 1.25 โมล/ ลิตร
เพราะ©Ð¹Ñé¹สารละลายมีความเข้มข้น
1.25 โมล/ ลิตร
และปฏิกิริยาการแตกตัวของ
NaOH เป็นดัง¹Õé
NaOH (aq) 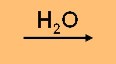 Na+
(aq) + OH- (aq) Na+
(aq) + OH- (aq)
1.25 โมล 1.25
โมล 1.25 โมล
เพราะ©Ð¹Ñé¹ความเข้มข้นของ
OH- = 1.25 โมล/ ลิตร
::¡ÅѺ´éÒ¹º¹::
การแตกตัวของกรดอ่อน
สารละลายกรดอ่อน
เช่น กรดแอซิติก
(CH3COOH) เมื่อละลายน้ำ
จะนำไฟฟ้าได้ไม่ดี
ทั้งนี้ เพราะกรดแอซิติกแตกตัวเป็นไอออนได้เพียงบางส่วน
เขียนแทนโดยสมการจะใช้ลูกศร
 เพื่อชี้ว่าปฏิกิริยาเกิดขึ้นทั้งปฏิกิริยาไปข้างหน้าและปฏิกิริยาย้อนกลับ
และอยู่ในภาวะสมดุลกัน
เช่น เพื่อชี้ว่าปฏิกิริยาเกิดขึ้นทั้งปฏิกิริยาไปข้างหน้าและปฏิกิริยาย้อนกลับ
และอยู่ในภาวะสมดุลกัน
เช่น
CH3COOH (aq) + H2O (l)  H3O+ (aq) + CH3COO-
(aq)
H3O+ (aq) + CH3COO-
(aq)
ปริมาณการแตกตัวของกรดอ่อน
นิยมบอกเป็นร้อยละ
เช่น กรด HA แตกตัวได้ร้อยละ
10 ในน้ำ หมายความว่า
กรด HA 1 โมล เมื่อละลายน้ำ
จะแตกตัวให้
H+
เพียง 0.10 โมล
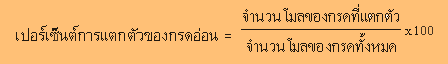
การแตกตัวของกรดของกรดอ่อนชนิดเดียวกัน
จะเพิ่มขึ้นเมื่อสารละลายมีความเจือจางมากขึ้น
เช่น กรดแอซิติก
CH3COOH ความเข้มข้นต่างกันจะมีเปอร์เซ็นต์การแตกตัวต่างกัน
ดังนี้
CH3COOH 1.0 M แตกตัวได้
0.42 %
CH3COOH 0.10 M แตกตัวได้
1.30 %
CH3COOH 0.010 M แตกตัวได้
4.20 %
::¡ÅѺ´éÒ¹º¹::
การแตกตัวของกรดมอนอโปรติก
(monoprotic acid dissociation)
กรดมอนอโปรติก
คือ กรด·Õèี่แตกตัวให้
H+ ได้เพียง
1 ตัว เช่น HCOOH และ
CH3COOH
HCOOH (aq) H+(aq)
+ HCOO-(aq) H+(aq)
+ HCOO-(aq)
CH3COOH (aq)  H+ (aq) + CH3COO- (aq)
H+ (aq) + CH3COO- (aq)
::¡ÅѺ´éÒ¹º¹::
การแตกตัวของกรดพอลิโปรติก
(polyprotic acid dissociation )
กรดพอลิโปรติก
หมายถึง
กรด·Õèี่มีโปรตอนมากกว่า
1 ตัว และสามารถแตกตัวให้
H+ ได้มากกว่า
1 ตัว ถ้าแตกตัวได้
H+
2 ตัว เรียกว่า
กรดไดโปรติก
เช่น H2CO3 , H2S
, H2C2O4 เป็นต้น
H2S  H+ + HS -
H+ + HS -
HS-  H+ + S2-
H+ + S2-
H2CO3  H+ + HCO3-
H+ + HCO3-
HCO3-  H+ + CO32-
H+ + CO32-
กรด·Õèี่แตกตัวให้
H+ ได้ 3 ตัว เรียกว่า
กรดไตรโปรติก
เช่น H3PO4 , H3PO3
H3PO3  H+ + H2PO4-
H+ + H2PO4-
H2PO4-  H+ + HPO42-
H+ + HPO42-
HPO42-  H+ + PO43-
H+ + PO43-
::¡ÅѺ´éÒ¹º¹::
ค่าคงที่สมดุลของกรดอ่อน
(Ka)
กรดอ่อนแตกตัวได้เพียงบางส่วน
ปฏิกิริยาการแตกตัวไปข้างหน้า
และปฏิกิริยาย้อนกลับเกิด¢Öé¹ได้พร้อมกัน
และปฏิกิริยาการแตกตัวของกรดอ่อน¹Õéี้จะอยู่ในภาวะสมดุล
ค่าคงที่สมดุล¹Õéี้จะหาได้ดังนี้

ค่าคง·Õèี่สมดุลของกรดนี้ใช้เปรียบเทียบความแรงของกรดได้
ถ้าค่า Kaมีค่ามากแสดงว่ากรดมีความแรงมาก
แตกตัวได้ดี
ถ้าค่า Ka น้อยแสดงว่ากรดแตกตัวได้น้อย
มีความแรงน้อย
สำหรับกรด·Õèี่แตกตัวได้
100% จะไม่มีค่า
Ka
ตัวอย่างค่า
Ka
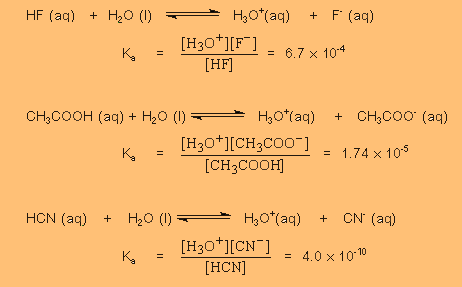
ถ้าเปรียบเทียบความแรงของกรดโดยใช้
Ka
Ka (HF) > Ka (CH3COOH) >
Ka (HCN)
เพราะ©Ð¹Ñé¹ความแรงของกรด
HF > CH3COOH > HCN

การคำนวณà¡ÕèÂÇกับกรดอ่อน
ตัวอย่าง·Õè
5 จงคำนวณเปอร์เซ็นต์การแตกตัวของกรด
HA 1 โมล/ ลิตร ซึ่งมี
H3O+ 0.05 โมล/ ลิตร
วิธีทำ
HA (aq) + H2O
(l)  H3O+
+ A- (aq) H3O+
+ A- (aq)
àÃÔèÁต้น
1 โมล/ ลิตร
0 0
ภาวะสมดุล
1 - 0.05
0.05 0.05 โมล/
ลิตร
ตัวอย่าง·Õè
6 สารละลายกรด
HA มีค่า Ka เป็น
6.8 x 10-4 สารละลายกรดนี้มีความเข้มข้น
1 โมล/ ลิตร สารละลายกรดนี้จะมีความเข้มข้นของ
H3O+ เท่าใด
วิธีทำ
HA (aq) + H2O (l)  H3O+ + A- (aq)
H3O+ + A- (aq)
àÃÔèÁต้น
1
0
0
ภาวะสมดุล
1 - x
x
x
ตัวอย่าง·Õè
7 ·Õèี่ 250C กรดแอซิติก
(CH3COOH) เข้มข้น
0.1 โมล/ ลิตร แตกตัวได้
1.34 % จงคำนวณหาความเข้มข้นของไฮโดรเนียมไอออน
แอซิเตตไอออน
และ Ka
วิธีทำ
0.1 mol/dm3 CH3COOH แตกตัวได้
1.34 % หมายความว่า
CH3COOH 100 mol/dm3แตกตัวได้
= 1.34 mol/dm3
CH3COOH 0.1 mol/dm3 แตกตัวได้
= = 0.00134
mol/dm 3 = 0.00134
mol/dm 3
CH
3COOH + H3O  H 3O+ + CH3COO-
H 3O+ + CH3COO-
àÃÔèÁต้น
0.1
0
0
ภาวะสมดุล
0.1- 0.00134
0.00134 0.00134
ตัวอย่าง·Õè
8 จงคำนวณหาความเข้มข้นของ
H+ , SO42- , และ
HSO4-ของสารละลายกรด
H2SO4 เข้มข้น
0.05 โมล/ ลิตร กำหนดค่า
Ka2 = 1.26 x 102-
วิธีทำ
กรด H2SO4เป็นกรดแก่แตกตัวได้
100 % ในขั้นที่
1
H2SO4 (aq) 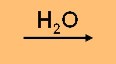 H+ (aq) + HSO4- (aq)
H+ (aq) + HSO4- (aq)
0.50 โมล/ ลิตร
¢Ñé¹·Õè 2 HSO4-(aq) แตกตัวให้
H+ และ SO42-(aq)
ดังนี้
HSO4- (aq)  H+ (aq) + SO42-(aq)
H+ (aq) + SO42-(aq)
àÃÔèÁต้น 0.50 0.50 0 ( ความเข้มข้นของ
HSO4- และ H+
ได้จากการแตกตัว¢Ñé¹·Õèี่1)
ภาวะสมดุล
0.50-x 0.50+x x
::¡ÅѺ´éÒ¹º¹::
การแตกตัวของเบสอ่อน
เบสอ่อนเมื่อละลายน้ำจะแตกตัวเป็นไอออนเพียงบางส่วน
และปฏิกิริยาการแตกตัวของเบสอ่อน
เป็นปฏิกิริยาที่ผันกลับได้
เช่น แอมโมเนีย
เมื่อละลายน้ำจะมีภาวะสมดุลเกิดขึ้น
ดังสมการ
NH3(aq) + H2O (l)  NH4+ (aq) + OH- (aq)
NH4+ (aq) + OH- (aq)
Kb คือ ค่าคงที่สมดุลของเบส
ค่า Kb นี้เป็นค่าคงที่และใช้เปรียบเทียบความแรงของเบสได้
เช่นเดียวกับค่า
Ka
- โมโนโปรติกเบส
(monoprotic base) จะรับ H+
ได้ 1 ตัว และมีค่า
Kb เพียงค่าเดียว
เช่น NH3
- โพลิโปรติกเบส
(polyprotic base) จะรับ H+
ได้มากกว่า
1 ตัว และมีค่า
Kb ได้หลายค่า
เช่น ไฮดราซีน
H2NNH2
H2NNH2+ H2O  H2NNH3++ OH- ; Kb1
= 9.1 x 10-7
H2NNH3++ OH- ; Kb1
= 9.1 x 10-7
H2NNH3+ + H2O  H3NNH3+ + OH- ; Kb2
= 1.0 x 10-15
H3NNH3+ + OH- ; Kb2
= 1.0 x 10-15
ตาราง·Õè 1¤èÒ¤§·ÕèÊÁ´ØÅของเบสอ่อนบางตัว
นอกจาก การบอกปริมาณการแตกตัวของเบสอ่อน
ในลักษณะของค่า
Kb แล้วก็ยังสามารถบอกปริมาณการแตกตัวของเบสอ่อนได้ในลักษณะของเปอร์เซ็นต์ของการแตกตัว
ดังนีé
ตัวอย่างการคำนวณ
ตัวอย่าง·Õè
9 จงเขียนค่าคงที่สมดุลของเบสอ่อนต่อไปนี้
C6H5NH2 , N2H2
วิธีทำ
ตัวอย่าง·Õè
10 จงคำนวณหาความเข้มข้นของ
OH - ในสารละลายแอมโมเนียเข้มข้น
0.200 โมล/ ลิตร กำหนดค่า
K b = 1.77 x 10-5
ÇÔ¸Õ·Ó
ตัวอย่าง·Õè
11 เมื่อแอมโมเนียละลาย¹éÓจะแตกตัวให้
NH4+ และ OH-
ถ้าแอมโมเนียจำนวน
0.106 โมล ละลายใน¹éÓ
1 ลิตร ·Õèภาวะสมดุลแตกตัวให้
NH4+ และ OH-
เท่ากัน คือ
1.38 x 10-3 โมล จงหาค่าคง·Õèี่ของการแตกตัวของ
NH3
วิธีทำ
ตัวอย่าง·Õè
12 สารละลาย
NH3 0.10 โมล/ ลิตร
แตกตัวให้
NH4+และ OH-
= 1.88 x 10 -3 โมล/ ลิตร
จะแตกตัวได้¡Õèี่เปอร์เซ็นต์
และถ้าสารละลายเบสเข้มข้น
0.20 โมล/ ลิตร จะแตกตัวได้¡Õèี่เปอร์เซ็นต์
วิธีทำ
กรณีสารละลายเบสเข้มข้น
0.2 โมล/ ลิตร
::¡ÅѺ´éÒ¹º¹::
|



