อินดิเคเตอร์สำหรับกรด-เบส
คืออะไร
อินดิเคเตอร์
คือ สารที่ใช้บอกความเป็นกรด-เบส ของสารละลายได้อย่างหนึ่ง
สารประกอบที่เปลี่ยนสีได้ที่ pH เฉพาะตัว จะถูกนำมาใช้เป็นอินดิเคเตอร์ได้
เช่น ฟีนอล์ฟทาลีน จะไม่มีสีเมื่ออยู่ในสารละลายกรด และจะเปลี่ยนเป็นสีชมพู
เมื่ออยู่ในสารละลายเบสที่มี pH 8.3
ภาพฟีนอล์ฟทาลีน
อินดิเคเตอร์สำหรับกรด-เบส
เป็นสารอินทรีย์ อาจเป็นกรดหรือเบสอ่อนๆ ซึ่งสามารถเปลี่ยนจากรูปหนึ่งไปเป็นอีกรูปหนึ่งได้
เมื่อ pH ของสารละลายเปลี่ยน
::กลับด้านบน::
การเปลี่ยนสีของอินดิเคเตอร์
HIn
เป็นสัญลักษณ์ของอินดิเคเตอร์ที่อยู่ในรูปกรด (Acid form)
In- เป็นสัญลักษณ์ของอินดิเคเตอร์ที่อยู่ในรูปเบส
(Basic form)
รูปกรดและรูปเบสมีภาวะสมดุล เขียนแสดงได้ด้วยสมการ ดังนี้
HIn (aq) + H2O (l) H3O+ (aq) + In- (aq)
H3O+ (aq) + In- (aq)
ไม่มีสี * สีชมพู* ; (* = กรณีเป็นฟีนอล์ฟทาลีน)
(รูปกรด) (รูปเบส)
| Kind = |
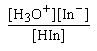 |
HIn และ In-
มีสีต่างกันและปริมาณต่างกัน จึงทำให้สีของสารละลายเปลี่ยนแปลงได้
ถ้าปริมาณ HInมากก็จะมีสีของรูปกรด ถ้ามีปริมาณ In-มากก็จะมีสีของรูปเบส
การที่จะมีปริมาณ HIn หรือ In มากกว่าหรือน้อยกว่านั้นขึ้นอยู่กับปริมาณ
H3O+ ในสารละลาย ถ้ามี H3O+
มากก็จะรวมกับ In- ได้เป็น HIn ได้มากจะเห็นสารละลายใสไม่มีสีของ HIn แต่ถ้าอยู่ในสารละลายที่มี
OH- มาก OH-จะทำปฏิกิริยากับ H3O+
ทำให้H3O+ ลดลง ซึ่งจะมีผลทำให้เกิดปฏิกิริยาไปข้างหน้าได้
In- มากขึ้น จะเห็นสารละลายในรูปของ In- คือเห็นเป็นสีชมพู
ช่วง
pH ที่อินดิเคเตอร์เปลี่ยนสีจากรูปหนึ่งไปเป็นอีกรูปหนึ่ง
สารละลายจะมีสีผสมระหว่างรูปกรดและรูปเบส เรียกว่า ช่วง pH
ของอินดิเคเตอร์ (pH range หรือ pH interval)
ช่วง
pH ของอินดิเคเตอร์หาได้จากค่า Kind ของอินดิเคเตอร์ดังนี้
HIn
(aq) + H2O (l) H3O+ (aq) + In- (aq)
H3O+ (aq) + In- (aq)
ไม่มีสี
* (รูปกรด) สีชมพู* (รูปเบส) ; (* = กรณีเป็นฟีนอล์ฟทาลีน)
| Kind = |
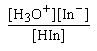 |
| [H3O+] = Kind |
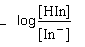 |
| -log [H3O+] = -logKind |
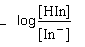 |
| pH = pKind |
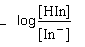 |
| - จะเริ่มเห็นสีของรูปกรดเมื่อ |
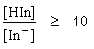 |
pH = pKind - log10
pH = pKind- 1
| - จะเริ่มเห็นสีของรูปเบสเมื่อ |
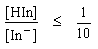 |
| pH = pKind - log |
 |
pH = pKind+ 1
นั่นคือ ช่วง pH ของอินดิเคเตอร์ = pKind 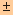 1 หมายความว่า
สีของอินดิเคเตอร์จะเริ่มเปลี่ยนแปลงเมื่อ pH = pKind
1 หมายความว่า
สีของอินดิเคเตอร์จะเริ่มเปลี่ยนแปลงเมื่อ pH = pKind
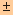 1 ซึ่งเป็นค่าโดยประมาณ
แต่ถ้า [HIn] มากกว่าหรือน้อยกว่า [In- ] 10 เท่าขึ้นไป
อาจถึง 100 เท่า ช่วง pH ของอินดิเคเตอร์ก็จะเปลี่ยนไป ช่วง
pH ของอินดิเคเตอร์ที่ถูกต้องจริงๆ ของแต่ละอินดิเคเตอร์หาได้จากการทดลอง 1 ซึ่งเป็นค่าโดยประมาณ
แต่ถ้า [HIn] มากกว่าหรือน้อยกว่า [In- ] 10 เท่าขึ้นไป
อาจถึง 100 เท่า ช่วง pH ของอินดิเคเตอร์ก็จะเปลี่ยนไป ช่วง
pH ของอินดิเคเตอร์ที่ถูกต้องจริงๆ ของแต่ละอินดิเคเตอร์หาได้จากการทดลอง
ตัวอย่างเช่น เมทิลเรด มีช่วง pH 4.4 - 6.2 หมายความว่า สารละลายที่หยดเมทิลเรดลงไป
จะเปลี่ยนสีจากรูปกรด (แดง) ไปเป็นรูปเบส (เหลือง) ในช่วง
pH ตั้งแต่ 4.4 - 6.2 นั่นคือ
- ถ้า pH < 4.4 จะให้สีแดง (รูปกรด)
- pH อยู่ระหว่าง 4.4 - 6.2 จะให้สีผสมระหว่างสีแดงกับเหลือง
คือ สีส้ม
- pH > 6.2 จะให้สีเหลือง (รูปเบส)
สีของอินดิเคเตอร์แต่ละชนิด จะเปลี่ยนในช่วง pH ที่ต่างกัน
ซึ่งแสดงได้ดังภาพ
ภาพแสดงสีของอินดิเคเตอร์แต่ละชนิด
อย่างไรก็ตาม
อินดิเคเตอร์ชนิดหนึ่งๆ จะใช้หาค่า pH ของสารละลายได้อย่างคร่าวๆ
เท่านั้น เช่น เมื่อนำสารละลายมาเติม เมทิลออเรนจ์ลงไป (ช่วง
pH ของเมทิลออเรนจ์เท่ากับ 3.0 - 4.4 และสีที่เปลี่ยนอยู่ในช่วง
สีแดง  เหลือง)
ถ้าสารละลายมีสีเหลืองหลังจากหยดเมทิลออเรนจ์ แสดงว่าสารละลายนี้มี
pH ตั้งแต่ 4.4 ขึ้นไป ซึ่งอาจมีฤทธิ์เป็นกรด กลางหรือ เบส ก็ได้
ดังนั้น การหาค่า pH ของสารละลายหนึ่งๆ อาจจะต้องใช้อินดิเคเตอร์หลายๆ
ตัว แล้วนำข้อมูลมาวิเคราะห์ pH ของสารละลายร่วมกัน เหลือง)
ถ้าสารละลายมีสีเหลืองหลังจากหยดเมทิลออเรนจ์ แสดงว่าสารละลายนี้มี
pH ตั้งแต่ 4.4 ขึ้นไป ซึ่งอาจมีฤทธิ์เป็นกรด กลางหรือ เบส ก็ได้
ดังนั้น การหาค่า pH ของสารละลายหนึ่งๆ อาจจะต้องใช้อินดิเคเตอร์หลายๆ
ตัว แล้วนำข้อมูลมาวิเคราะห์ pH ของสารละลายร่วมกัน
ตัวอย่าง การทดลองหาค่า
pH ของสารละลายชนิดหนึ่ง โดยใช้อินดิเคเตอร์ 5 ชนิดด้วยกัน
ผลการทดลองเป็นดังนี้
ชนิดของอินดิเคเตอร์ |
ช่วง
pH |
สีที่เปลี่ยน |
สีสารละลายที่ได้จากการทดลอง |
1. methyl yellow
2. Bromeresol green
3. Methyl red
4. Bromothymol blue
5. Phenophtalein |
2.9-4.0
3.8-5.4
4.4-6.2
6.0-7.6
8.0-9.6 |
สีแดง-เหลือง
เหลือง-น้ำเงิน
แดง-เหลือง
เหลือง-น้ำเงิน
ไม่มีสี-สีชมพู |
เหลือง
น้ำเงิน
ส้ม
เหลือง
ไม่มีสี |
ให้หาค่า
pH ของสารละลายจากข้อมูลการทดลองข้างต้น
แนวคิด จากอินดิเคเตอร์ชนิดที่ 1 แสดงว่า pH ของสารละลาย >
4 จากอินดิเคเตอร์ชนิดที่ 2 แสดงว่า pH ของสารละลายอยู่ระหว่าง
4.4-6.2 จากอินดิเคเตอร์ชนิดที่ 3 แสดงว่า pH ของสารละลาย
> 5.4 จากอินดิเคเตอร์ชนิดที่ 4 แสดงว่า pH ของสารละลาย
< 6 จากอินดิเคเตอร์ชนิดที่ 5 แสดงว่า pH ของสารละลาย <
8.0 สรุปได้ว่า สารละลายมี pH อยู่ระหว่าง 5.4 - 6
การหา
pH ของสารละลายโดยใช้อินดิเคเตอร์หลายๆ ชนิดนี้ ไม่สะดวกในการใช้
จึงมีการคิดที่จะนำอินดิเคเตอร์หลายๆ ชนิด ซึ่งเปลี่ยนสีในช่วง
pH ต่างๆ กันมาผสมกันในสัดส่วนที่เหมาะสม จะสามารถใช้บอกค่า
pH ของสารละลายได้ละเอียดขึ้น อินดิเคเตอร์ผสมนี้เรียกว่า
ยูนิเวอร์ซัลอินดิเคเตอร์ ซึ่งสามารถเปลี่ยนสีได้ในสารละลายที่มี
pH ต่างๆ กันเกือบทุกค่า
การใช้ยูนิเวอร์ซัลอินดิเคเตอร์
หยดยูนิเวอร์ซัลอินดิเคเตอร์ลงในสารละลายที่ต้องการหาค่า pH
ประมาณ 3 หยดต่อสารละลาย 3 cm3 สังเกตสีของสารละลายแล้วเปรียบเทียบกับสีมาตรฐานของยูนิเวอร์ซัลอินดิเคเตอร์ที่
pH ต่างๆ ว่าสีของสารละลายตรงกับสีมาตรฐานที่ pH ใด ก็จะมีค่าเท่ากับ
pH นั้น
ตาราง การเปลี่ยนสีของสารละลาย เมื่อใช้ยูนิเวอร์ซัลอินดิเคเตอร์
pH สารละลาย |
สี |
3 |
แดง |
4 |
ส้มแดง |
5 |
ส้ม |
6 |
ส้มเหลือง |
7 |
เหลืองเขียว |
8 |
เขียว |
9 |
น้ำเงินเขียว |
10 |
ม่วง |
11 |
ม่วงแดง |
::กลับด้านบน::
|