กฏข้อที่หนึ่งของเทอร์โมไดนามิกส์ มีพื้นฐานมาจากกฎอนุรักษ์พลังงาน ซึ่งมีใจความว่า พลังงานสามารถเปลี่ยนจากรูปหนึ่งไปเป็นอีกรูปหนึ่งได้ แต่ไม่สามารถสร้างหรือทำให้พลังงานหายไปได้
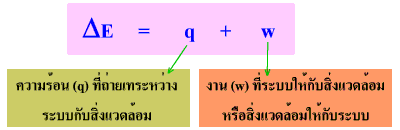
เราสามารถตรวจสอบความถูกต้องของกฎนี้ได้โดยการวัดการเปลี่ยนแปลงพลังงานภายในของระบบ (ใช้สัญลักษณ์เป็น DE หรือ DU) เทียบกับความแตกต่างระหว่างสภาวะเริ่มต้นกับสภาวะสุดท้ายของระบบ DE = Ef - Ei ในทางเคมี เรามักจะสนใจการเปลี่ยนแปลงที่เกิดขึ้นในระบบมากกว่าในสิ่งแวดล้อม ซึ่งการเปลี่ยนแปลงพลังงานภายในของระบบ (DE) มีค่าเท่ากับผลรวมของความร้อน (q) กับงาน (w) ดังนี้
(q มีค่าเป็นบวกสำหรับกระบวนการดูดความร้อน และมีค่าเป็นลบสำหรับกระบวนการคายความร้อน) กฏข้อที่หนึ่งของเทอร์โมไดนามิกส์ กล่าวว่า "พลังงานรวมของทั้งระบบและสิ่งแวดล้อมต้องมีค่าคงที่ แต่พลังงานสามารถเปลี่ยนรูปจากรูปหนึ่งไปเป็นอีกรูปหนึ่งได้"
นั่นคือ การเปลี่ยนแปลงพลังงาน (DE) จะเท่ากับปริมาณความร้อนที่ถ่ายเท (q)
|
||||||||||||||||||||