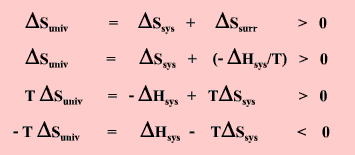|
สมการนี้บอกให้ทราบว่า สำหรับกระบวนการที่เกิดขึ้นที่อุณหภูมิ T ถ้าเอนทัลปีและเอนโทรปีของระบบเปลี่ยนไปในทิศทางที่ทำให้ DHsys - TDSsys มีค่าน้อยกว่าศูนย์แล้วกระบวนการนั้นจะต้องเกิดขึ้นได้เอง และเราเรียกฟังก์ชันใหม่นี้ว่า พลังงานอิสระกิบส์ (Gibbs free energy) โดย G = H - TS เมื่อกระบวนการนั้นเป็นกระบวนการอุณหภูมิคงที่ (isothermal process)
จะเห็นได้ว่าปริมาณทั้งหมด (H, T และ S) เป็นสมบัติของระบบ ดังนั้น
G ก็ต้องเป็นฟังก์ชันสภาวะและมีหน่วยเป็นพลังงาน
DG
< 0 ปฏิกิริยาเกิดขึ้นได้เองในทิศทางไปข้างหน้า
การเปลี่ยนแปลงพลังงานอิสระมาตรฐาน (DGo) คือ การเปลี่ยนแปลงพลังงานอิสระของปฏิกิริยาที่เกิดขึ้นภายใต้สภาวะมาตรฐานหรือการที่สารตั้งต้นเปลี่ยนไปเป็นสารผลิตภัณฑ์ที่สภาวะมาตรฐาน
เมื่อ DGo คือ การเปลี่ยนแปลงพลังงานอิสระมาตรฐานของการเกิด (standard free energy of formation) ของสารประกอบ ซึ่งเป็นการเปลี่ยนแปลงพลังงานอิสระในการเกิดปฏิกิริยาการเกิดสารประกอบนั้น 1 โมล จากธาตุองค์ประกอบที่สภาวะมาตรฐาน n คือ
จำนวนโมลของสารตั้งต้น เรามาดูตัวอย่างกันดีกว่า 2 MgO (s) ------------> 2 Mg (s) + O2 (g) การเปลี่ยนแปลงพลังงานอิสระมาตรฐาน คือ DGorxn = [2 DGof(Mg) +DGof(O2)] - [2DGof(MgO)] แต่เนื่องจากธาตุทุกชนิดในสภาพที่เสถียรมีพลังงานอิสระมาตรฐานของการเกิดเป็นศูนย์ ดังนั้น DGof(Mg) = 0 และ DGof(O2) = 0 การเปลี่ยนแปลงพลังงานอิสระมาตรฐานของปฏิกิริยา คือ DGorxn = - 2 DGof(MgO) = - 2 (-569.6 kJ/mol) = 1139.2 kJ/mol [จากตาราง ค่า DGof(MgO) = - 569.6 kJ/mol] หมายเหตุ DGo มีหน่วยเป็น kJ ส่วน DGof มีหน่วยเป็น kJ/mol |