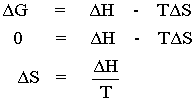|
นอกจากนี้ การเปลี่ยนแปลงพลังงานอิสระยังสามารถนำมาอธิบายการเปลี่ยนวัฏภาคของสสารได้อีกด้วย ซึ่งจะได้ศึกษากันในเรื่องนี้
ณ อุณหภูมิที่มีการเปลี่ยนแปลงวัฏภาค (phase transition) เช่น จุดเดือดหรือจุดหลอมเหลว จะได้ว่า DGo = 0 ดังนั้น
พิจารณาสมดุลระหว่างน้ำแข็งกับน้ำ สำหรับการเปลี่ยนวัฏภาคจากน้ำแข็งเป็นน้ำ (ice -----> water) โดย DH เป็นความร้อนของการหลอมเหลวต่อโมล (molar heat of fusion) และ T คือ จุดหลอมเหลวของน้ำ จะได้ว่า การเปลี่ยนแปลงเอนโทรปี (DS) มีค่าเป็น
เมื่อน้ำแข็ง 1 mol หลอมเหลวที่ 0 oC เอนโทรปีของระบบจะเพิ่มขึ้น 22 J/K การที่เอนโทรปีเพิ่มขึ้น แสดงว่าการเปลี่ยนวัฏภาคจากน้ำแข็งเป็นน้ำเป็นกระบวนการที่เพิ่มความไม่เป็นระเบียบ (disorder or random) ของระบบให้มากขึ้น ในทางกลับกัน การเปลี่ยนแปลงเอนโทรปี (DS) ของการเปลี่ยนวัฏภาคจากน้ำเป็นน้ำแข็ง ( water -----> ice transition) จะมีค่าดังนี้
เราสามารถหาการเปลี่ยนแปลงเอนโทรปีของการเปลี่ยนวัฏภาคระหว่างน้ำกับน้ำแข็งได้ง่ายๆ จากสูตร DS = DH/T (ทั้งนี้อุณหภูมิต้องคงที่ คือ อยู่ที่ 0 oC) และเรายังสามารถประยุกต์ใช้สูตรนี้ในการหาการเปลี่ยนแปลงเอนโทรปีของการเปลี่ยนวัฏภาคระหว่างน้ำกับไอน้ำได้อีกด้วย แต่ DH ในที่นี้จะเป็นความร้อนของการกลายเป็นไอต่อโมล (molar heat of fusion) และ T คือ จุดเดือดของน้ำ แผนภาพวัฏภาคของน้ำ (Phase diagram of water)
Triple point (จุดร่วมสาม, A) คือ ความดันและอุณหภูมิที่จะมีสารปรากฏอยู่ทั้งสามสถานะ คือ ของแข็ง ของเหลว และไอ Critical point (จุดวิกฤติ, C) คือ จุดที่เมื่ออุณหภูมิสูงกว่าจุดนี้ สารจะมีสถานะเป็นไอเสมอไม่ว่าความดันจะเป็นเท่าใดก็ตาม (อยู่ในบริเวณ SCF ซึ่งสารจะอยู่สถานะของไหล) Melting point (จุดหลอมเหลว, Tm) คือ อุณหภูมิที่ทั้งของแข็งและของเหลวอยู่ในสมดุลกัน ณ ความดันบรรยากาศ Boiling point (จุดเดือด, Tb) คือ อุณหภูมิที่ความดันไอของของเหลวมีค่าเท่ากับความดันบนของเหลว
จะสังเกตเห็นว่า เส้นตรง AD เอนไปทางซ้ายมือ ซึ่งเป็นผลที่ได้จากการทดลอง การที่เส้นตรง AD เอนไปทางซ้ายมือ หมายความว่า ในสภาวะที่ความดันสูงขึ้น จุดหลอมเหลวของน้ำจะมีค่าลดลง แต่ถ้าเราพิจารณาเส้นโค้ง AC เราจะเห็นว่า ในสภาวะที่ความดันสูงขึ้น จุดเดือดของน้ำจะมีค่าสูงขึ้น
เราอาจจะไม่เคยเห็นปรากฏการณ์นี้
เพราะถ้าเป็นระบบของน้ำบริสุทธิ์ ปรากฏการณ์นี้จะเกิดที่ความดัน
0.006 atm และอุณหภูมิ 0.01 oC แต่ก็มีปรากฏการณ์ที่ใกล้เคียงที่สามารถพบสารได้ทั้ง
3 สถานะ
เช่น เวลาที่เราแช่เบียร์หรือน้ำอัดลมไว้ที่อุณหภูมิต่ำกว่าศูนย์องศาเซลเซียส
(ประมาณ -10 oC) เราจะเห็นว่า เบียร์หรือน้ำอัดลมยังคงเป็นของเหลวอยู่เหมือนเดิม
(อย่าลืมนะครับว่า ความดันภายในขวดเบียร์หรือขวดน้ำอัดลมจะมากกว่าความดันบรรยากาศภายนอก
2 - 3 เท่า) แต่พอเราเปิดฝาขวดออก ความดันภายในขวดจะลดลงอย่างรวดเร็วจนเหลือประมาณ
1 atm แต่อุณหภูมิยังเท่าเดิม คือ ประมาณ -10 oC ทำให้เบียร์หรือน้ำอัดลมมีทั้ง
3 สถานะ ซึ่งเราเรียกกันว่าน้ำอัดลมหรือเบียร์วุ้น
ซึ่งมีส่วนประกอบ 3 ส่วน ดังนี้
|