
เดี๋ยวเรามาดูกันต่อเลยนะครับว่า
ปฏิกิริยาเคมีกับอุณหภูมิสัมพันธ์กันอย่างไร ?

แคลเซียมออกไซด์
(CaO) หรือปูนสุก (quicklime) เป็นสารอนินทรีย์ที่มีประโยชน์มากในอุตสาหกรรมการผลิตเหล็กกล้า
(steelmaking) การผลิตโลหะแคลเซียม (Ca) และการผลิตกระดาษ ซึ่งแคลเซียมออกไซด์
(CaO) สามารถเตรียมได้จากการสลายตัวของแคลเซียมคาร์บอเนตหรือหินปูน
(CaCO3) ในเตาเผาที่อุณหภูมิสูง
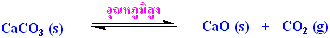
ปฏิกิริยานี้เป็นปฏิกิริยาที่ย้อนกลับได้ โดย CO2 สามารถรวมตัวกับ
CaO กลับมาเป็น CaCO3 ได้เหมือนเดิม ซึ่งความดันที่มาจากแก๊ส
CO2 ที่อยู่ในสมดุลกับ CaO และ CaCO3 จะขึ้นอยู่กับอุณหภูมิ
ถ้าอุณหภูมิเพิ่ม ความดันก็จะเพิ่มตาม
ดังนั้น
ในกระบวนการผลิตแคลเซียมออกไซด์หรือปูนสุก จึงต้องมีการดูดเอาแก๊ส
CO2 ที่เกิดขึ้นออกจากปฏิกิริยา เพื่อให้ปฏิกิริยาเกิดไปข้างหน้าได้ดีขึ้น
นั่นก็คือ เพื่อที่จะเพิ่มปริมาณของแคลเซียมออกไซด์ให้มากขึ้น
 |
ถ้าเราอยากทำให้ปฏิกิริยาการเตรียมแคลเซียมออกไซด์เป็นกระบวนการที่เกิดได้เองได้
เราต้องทำอย่างไรครับ ? |
เราสามารถคำนวณหาอุณหภูมิที่ทำให้ปฏิกิริยาการเตรียมแคลเซียมออกไซด์เป็นกระบวนการที่เกิดได้เองได้
โดยเราต้องคำนวณหา DHo
สำหรับปฏิกิริยาที่ 25 oC ก่อน
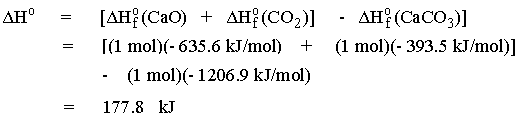
จากค่า
So เราก็จะคำนวณหา DSo
สำหรับปฏิกิริยาที่ 25 oC ได้
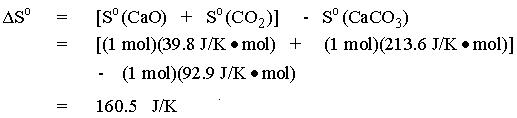
สำหรับปฏิกิริยาที่สภาวะมาตรฐาน
จะได้ว่า


เนื่องจาก
DGo มีค่าเป็นบวก
แสดงว่าที่ 25 oC ปฏิกิริยานี้จะเกิดเองไม่ได้ แต่เมื่ออุณหภูมิเพิ่มขึ้นเรื่อยๆ
TDSo จะมีค่าเพิ่มขึ้น
จนในที่สุดจะเท่ากับ DHo
เมื่อ DGo = 0

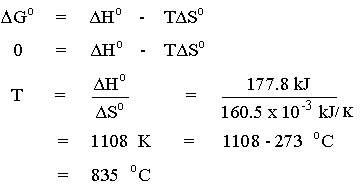
แสดงว่าที่อุณหภูมิสูงกว่า
835 oC ค่า DGo
จะเป็นลบ และปฏิกิริยานี้ก็จะเกิดขึ้นได้เอง เช่น ที่อุณหภูมิ
850 oC หรือ 1123 K จะได้ว่า
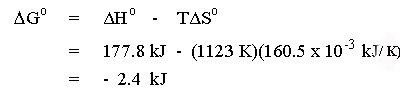
 |
ในการคำนวณเราต้องคำนึงถึงอะไรบ้างครับ
? |
สิ่งที่ต้องคำนึงถึงในการคำนวณ
1.ค่าของ
DGo ที่คำนวณได้อาจคลาดเคลื่อนไปบ้าง
เนื่องจาก DHo และ
DSo ขึ้นอยู่กับอุณหภูมิ
2.
การที่
DGo มีค่าเป็นศูนย์ที่
835 oC
 ไม่ได้หมายความว่าที่อุณหภูมิต่ำกว่านี้ ปฏิกิริยาการเตรียมแคลเซียมออกไซด์จะไม่เกิดขึ้นเลย
ไม่ได้หมายความว่าที่อุณหภูมิต่ำกว่านี้ ปฏิกิริยาการเตรียมแคลเซียมออกไซด์จะไม่เกิดขึ้นเลย
 ไม่ได้หมายความว่าแคลเซียมคาร์บอเนต
(CaCO3) จะสลายตัวทันทีเมื่ออุณหภูมิเพิ่มถึง 835 oC
ไม่ได้หมายความว่าแคลเซียมคาร์บอเนต
(CaCO3) จะสลายตัวทันทีเมื่ออุณหภูมิเพิ่มถึง 835 oC
3.
การที่ DGo
มีค่าเป็นบวกที่อุณหภูมิต่ำกว่า 835 oC
 ไม่ได้หมายความว่ายังไม่มีแก๊สคาร์บอนไดออกไซด์เกิดขึ้น
หากแต่หมายความว่ามีแก๊สคาร์บอนไดออกไซด์เกิดขึ้นแต่มีความดันต่ำกว่า
1 atm
ไม่ได้หมายความว่ายังไม่มีแก๊สคาร์บอนไดออกไซด์เกิดขึ้น
หากแต่หมายความว่ามีแก๊สคาร์บอนไดออกไซด์เกิดขึ้นแต่มีความดันต่ำกว่า
1 atm