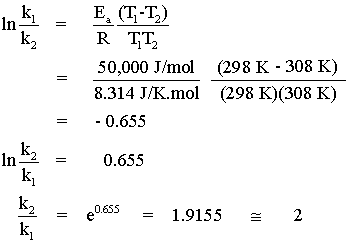![]()
![]() จากกฎอัตรา เราสามารถบอกถึงความสัมพันธ์ระหว่างอัตราการเกิดปฏิกิริยากับสภาวะต่างๆ
ที่มีการเปลี่ยนแปลงได้ทั้งหมดหรือไม่?
จากกฎอัตรา เราสามารถบอกถึงความสัมพันธ์ระหว่างอัตราการเกิดปฏิกิริยากับสภาวะต่างๆ
ที่มีการเปลี่ยนแปลงได้ทั้งหมดหรือไม่?
จากกฎอัตรา rate = k [A]m[B]n บอกได้แต่เพียงว่า การเปลี่ยนแปลงความเข้มข้นมีผลต่อการเปลี่ยนแปลงอัตราการเกิดปฏิกิริยา แต่ค่าคงที่อัตราอาจเปลี่ยนแปลงไปได้เมื่ออุณหภูมิเปลี่ยนไปหรือมีการใช้ตัวเร่งปฏิกิริยา
เราหาคำตอบว่า ค่าคงที่อัตราเปลี่ยนแปลงไปอย่างไรเมื่ออุณหภูมิและพลังงานก่อกัมมันต์(ใช้ตัวเร่งปฏิกิริยา)เปลี่ยนไป จากสมการนี้ไม่ได้เช่นกัน แต่มีสมการอยู่สมการหนึ่งที่สามารถบอกความสัมพันธ์ของสามตัวแปรนี้ได้ นั่นคือ สมการอาร์เรเนียส (Arrhenius equation)
จากการสังเกต เราจะเห็นได้ว่า ค่าคงที่อัตราของปฏิกิริยาส่วนใหญ่จะเป็นไปตาม สมการของอาร์เรเนียส
![]()
ถ้าเราเขียนสมการให้อยู่ในรูปลอกาลิทึมธรรมชาติ จะได้ว่า
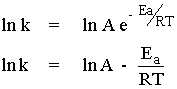
ถ้าเราเขียนกราฟแสดงความสัมพันธ์ระหว่าง ln k กับ 1/T จะได้กราฟเป็นเส้นตรง และมีค่าความชันเท่ากับ -Ea/R และมีจุดตัดแกน ln k ที่จุด ln k = ln A
| เมื่อ | A | = แฟกเตอร์ความถี่ (frequency factor) ซึ่งมีค่าคงที่ในช่วงอุณหภูมิที่กว้างพอสมควรสำหรับแต่ละปฏิกิริยา |
| Ea | = พลังงานก่อกัมมันต์ (activation energy) ของปฏิกิริยา (kJ/mol) | |
| R | = ค่าคงที่ของแก๊ส (8.314 J/K.mol) | |
| T | = อุณหภูมิสัมบูรณ์ (หน่วย K) |
เราจะเรียกแฟกเตอร์ความถี่และพลังงานก่อกัมมันต์ ว่าเป็นพารามิเตอร์ของอาร์เรเนียส (Arrhenius parameter)
จากความสัมพันธ์ระหว่างค่าคงที่อัตรา k1 กับอุณหภูมิ T1 และค่าคงที่อัตรา k2 กับอุณหภูมิ T2 เราก็สามารถคำนวณหาพลังงานก่อกัมมันต์ หรือคำนวณหาค่าคงที่อัตราที่อุณหภูมิอื่นเมื่อทราบค่าพลังงานก่อกัมมันต์ได้
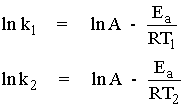
นำ ln k2 ไปลบออกจาก ln k1 จะได้ว่า
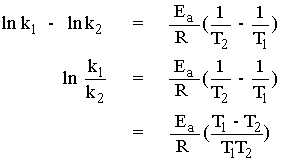
สำหรับปฏิกิริยาง่ายๆ อาจถือว่าแฟกเตอร์ความถี่เท่ากับความถี่ของการชนระหว่างอนุภาคของสารตั้งต้น แต่สำหรับปฏิกิริยาซับซ้อนมากขึ้นเราจะต้องคำนึงถึงการจัดตัวของโมเลกุลขณะเข้าชนด้วย
คราวนี้ลองมาพิสูจน์กันว่า ถ้ามีการเปลี่ยนแปลงอุณหภูมิและใส่ตัวเร่งปฏิกิริยา (เกี่ยวข้องกับพลังงานก่อกัมมันต์) จะมีผลต่ออัตราการเกิดปฏิกิริยาจริงหรือไม่
ตัวอย่าง
ปฏิกิริยาหนึ่งมีพลังงานก่อกัมมันต์ 50,000 J/mol อัตราการเกิดปฏิกิริยาจะเปลี่ยนแปลงไปอย่างไร
เมื่อ
ก)
เพิ่มอุณหภูมิให้กับปฏิกิริยาจาก 25 oC เป็น 35 oC
ข)
ที่อุณหภูมิ 25 oC ใส่ตัวเร่งปฏิกิริยาลงไป ทำให้พลังงานก่อกัมมันต์ลดลงเหลือ
25,000 J/mol
| ก) จาก |
|
|
|
| ข) จาก |
|
| เมื่อไม่มีตัวเร่งปฏิกิริยา | |
| เมื่อมีตัวเร่งปฏิกิริยา | |
| เมื่อเปรียบเทียบระหว่างสองปฏิกิริยา จะได้ว่า | |
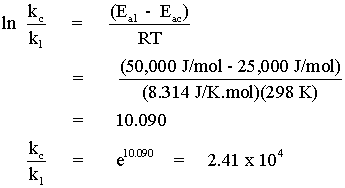 |
|
| จะเห็นได้ว่า อัตราการเกิดปฏิกิริยาจะเปลี่ยนแปลงไปอย่างมหาศาล มาถึงขั้นนี้แล้ว เราคงจะทราบแล้วว่า ในทางปฏิบัติ การใช้ตัวเร่งปฏิกิริยาจะมีผลทำให้อัตราการเกิดปฏิกิริยาเพิ่มขึ้นได้มากกว่าการเพิ่มอุณหภูมิอย่างมหาศาล | |