![]()
หลายๆ คนอาจมีคำถามอยู่ในใจว่า "ปฏิกิริยาเกิดขึ้นได้อย่างไร" ซึ่งนักวิทยาศาสตร์ก็พยายามที่จะใช้ทฤษฎีอธิบายการเกิดปฏิกิริยา หนึ่งในทฤษฎีที่อธิบายการเกิดปฏิกิริยาได้ค่อนข้างชัดเจน คือ ทฤษฎีการชน (collision theory) ซึ่งกล่าวว่า "ปฏิกิริยาจะเกิดขึ้นก็ต่อเมื่ออนุภาคของตัวทำปฏิกิริยา (อะตอม โมเลกุล หรือไอออน ) เกิดการชนกัน ถ้าการชนนั้นมีทิศทางที่เหมาะสมและมีพลังงานมากพอก็จะทำให้พันธะเดิมแตกออกและสร้างเป็นพันธะใหม่ขึ้นมา" ซึ่งทฤษฎีการชนนี้จะอธิบายได้เฉพาะปฏิกิริยาเคมีที่มีสารเข้าทำปฏิกิริยาตั้งแต่สองอนุภาคขึ้นไป โดยอาจเป็นสองอนุภาคที่เหมือนกันหรือแตกต่างกันก็ได้
จากทฤษฎีการชนจะสังเกตได้ว่า การชนที่ประสบผลสำเร็จหรือการชนที่ทำให้เกิดสารผลิตภัณฑ์จะต้องประกอบด้วยองค์ประกอบที่สำคัญสองอย่าง คือ
1. ทิศทางของการชน (orientation of collision)
2. พลังงานของการชน (energy of collision)
1. ทิศทางของการชน
ตัวอย่าง ปฏิกิริยาระหว่างโพแทสเซียมอะตอม (K) กับเมทิลไอโอไดด์ (CH3I) ได้เป็นโพแทสเซียมไอโอไดด์ (KI) และอนุมูลเมทิล (CH3)
ปฏิกิริยานี้จะเกิดได้ดีที่สุดเมื่อ K ชนกับ I ในทิศทางที่โมเลกุล CH3I หันด้านอะตอมของ I เข้าหา K โดยตรง ส่วนการชนที่อะตอมของ K ชนกับ CH3 นั้นจะเป็นการชนที่เกิดผลิตภัณฑ์น้อยมากหรือแทบจะไม่เกิดเลย ดังนั้นในการศึกษาจลนพลศาสตร์เคมีจึงควรพิจารณาการจัดตัวของโมเลกุลขณะเกิดการชนด้วย
ถ้าจะมองในเรื่องของทฤษฎีการชนแล้ว เราก็คงพอจะมองภาพออกว่า ถ้าสารตั้งต้นเป็นแก๊สหรือของเหลวคงเกิดปฏิกิริยาได้ง่าย เพราะอนุภาคที่เป็นแก๊สหรือของเหลวเคลื่อนที่ได้ง่าย โดยเฉพาะแก๊ส ถ้าเราใช้ความดันช่วยบีบให้อนุภาคเข้ามาชิดกันมากขึ้น ปฏิกิริยาก็จะยิ่งเกิดได้ง่ายมากขึ้น
2. พลังงานของการชน
อนุภาคชนกันในทิศทางที่เหมาะสมแล้วก็ยังไม่เพียงพอ สิ่งที่สำคัญมากกว่านั้นก็คือ พลังงาน เพราะถึงแม้ว่าอนุภาคจะชนกันในทิศทางที่ถูกต้องแต่พลังงานของอนุภาคมีไม่มากเพียงพอ ก็ไม่อาจที่จะเกิดปฏิกิริยาได้
เราได้ทราบมาแล้วว่าการเกิดปฏิกิริยาเคมีย่อมเกี่ยวข้องกับการสลายพันธะเดิมและสร้างพันธะใหม่ ซึ่งการสลายพันธะเดิมต้องใช้พลังงานอย่างแน่นอน พลังงานในที่นี้ก็คือพลังงานที่เราเรียกว่า พลังงานก่อกัมมันต์ (activation energy) นั่นเอง
![]()
อนุภาคที่ชนกันต้องมีพลังงานจลน์รวมกันแล้วมีค่าอย่างน้อยเท่ากับพลังงานก่อกัมมันต์
(activation energy, Ea) ซึ่งเป็นพลังงานต่ำที่สุดที่ทำให้เกิดปฏิกิริยาได้
ถ้ามีพลังงานต่ำกว่านี้ก็จะไม่เกิดปฏิกิริยา แต่ถ้ามีพลังงานจลน์หลังการชนมากกว่าหรือเท่ากับพลังงานก่อกัมมันต์
อนุภาคของสารตั้งต้นที่เข้าชนกันก็จะรวมตัวกันเกิดเป็นสารประกอบเชิงซ้อนกัมมันต์
(activated complex) ซึ่งสารเชิงซ้อนนี้จะอยู่ตัวได้เพียงชั่วขณะ
หลังจากนั้นจะเปลี่ยนไปเป็นสารผลิตภัณฑ์
พิจารณาปฏิกิริยา A + B --------> C + D
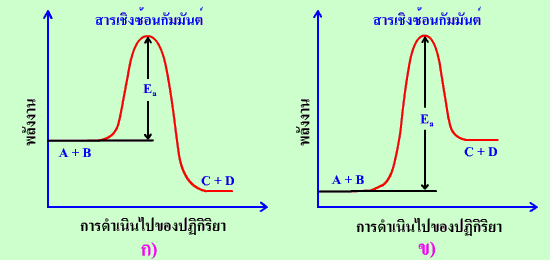
กราฟแสดงการเปลี่ยนแปลงพลังงานศักย์สำหรับ
ก) ปฏิกิริยาคายความร้อน ข) ปฏิกิริยาดูดความร้อน
จากกราฟ
![]() ถ้าสารผลิตภัณฑ์ที่เกิดขึ้นมีพลังงานต่ำกว่าสารตั้งต้น (สารผลิตภัณฑ์เสถียรกว่าสารตั้งต้น)
ในขณะเกิดปฏิกิริยาก็จะมีการคายความร้อนควบคู่ไปด้วย เราจึงเรียกปฏิกิริยาชนิดนี้ว่า
ปฏิกิริยาคายความร้อน (exothermic reaction)
ถ้าสารผลิตภัณฑ์ที่เกิดขึ้นมีพลังงานต่ำกว่าสารตั้งต้น (สารผลิตภัณฑ์เสถียรกว่าสารตั้งต้น)
ในขณะเกิดปฏิกิริยาก็จะมีการคายความร้อนควบคู่ไปด้วย เราจึงเรียกปฏิกิริยาชนิดนี้ว่า
ปฏิกิริยาคายความร้อน (exothermic reaction)
![]() ถ้าสารผลิตภัณฑ์ที่เกิดขึ้นมีพลังงานมากกว่าสารตั้งต้น (สารผลิตภัณฑ์เสถียรน้อยกว่าสารตั้งต้น)
ในขณะเกิดปฏิกิริยาก็จะมีการดูดความร้อนควบคู่ไปด้วย เราจึงเรียกปฏิกิริยาชนิดนี้ว่า
ปฏิกิริยาดูดความร้อน (endothermic reaction)
ถ้าสารผลิตภัณฑ์ที่เกิดขึ้นมีพลังงานมากกว่าสารตั้งต้น (สารผลิตภัณฑ์เสถียรน้อยกว่าสารตั้งต้น)
ในขณะเกิดปฏิกิริยาก็จะมีการดูดความร้อนควบคู่ไปด้วย เราจึงเรียกปฏิกิริยาชนิดนี้ว่า
ปฏิกิริยาดูดความร้อน (endothermic reaction)
![]() พลังงานก่อกัมมันต์เปรียบเสมือนผนังกั้นอนุภาคที่มีพลังงานต่ำกว่าพลังงานก่อกัมมันต์ไม่ให้เกิดปฏิกิริยา
ในปฏิกิริยาทั่วๆ ไป อนุภาคของสารตั้งต้นมักมีจำนวนมาก แต่จะมีจำนวนอนุภาคเพียงบางส่วนที่มีพลังงานจลน์มากพอที่จะข้ามผนังนี้ไปได้
ซึ่งอนุภาคเหล่านี้เป็นอนุภาคที่มีโอกาสชนกันแล้วเกิดปฏิกิริยา
พลังงานก่อกัมมันต์เปรียบเสมือนผนังกั้นอนุภาคที่มีพลังงานต่ำกว่าพลังงานก่อกัมมันต์ไม่ให้เกิดปฏิกิริยา
ในปฏิกิริยาทั่วๆ ไป อนุภาคของสารตั้งต้นมักมีจำนวนมาก แต่จะมีจำนวนอนุภาคเพียงบางส่วนที่มีพลังงานจลน์มากพอที่จะข้ามผนังนี้ไปได้
ซึ่งอนุภาคเหล่านี้เป็นอนุภาคที่มีโอกาสชนกันแล้วเกิดปฏิกิริยา
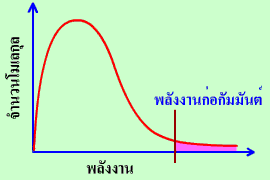
รูปการแจกแจงพลังงานของอนุภาคของแมกซ์เวล-โบลซ์มันน์ (Maxwell-Boltzmann Distribution)
| หมายเหตุ : | พลังงานก่อกัมมันต์เป็นพลังงานรวมเมื่อโมเลกุลชนกัน ไม่ใช่พลังงานของแต่ละโมเลกุล ดังนั้น โมเลกุลที่มีพลังงานต่ำกว่า Ea อาจชนกันแล้วมีพลังงานถึง Ea ได้ |
อนุภาคในพื้นที่ใต้กราฟทางด้านขวาของพลังงานก่อกัมมันต์เท่านั้นที่มีโอกาสชนกันแล้วเกิดปฏิกิริยาเพราะเป็นอนุภาคที่มีพลังงานสูง ส่วนอนุภาคในพื้นที่ใต้กราฟทางด้านซ้ายของพลังงานก่อกัมมันต์ซึ่งเป็นอนุภาคส่วนใหญ่จะมีโอกาสชนกันได้แต่ไม่มีพลังงานมากพอที่จะเกิดปฏิกิริยา
![]() ถ้าอนุภาคไม่มีพลังงานมากพอที่จะทำปฏิกิริยา ต้องทำอย่างไร
ถ้าอนุภาคไม่มีพลังงานมากพอที่จะทำปฏิกิริยา ต้องทำอย่างไร
ก. เปลี่ยนรูปร่างของกราฟให้โย้ไปทางขวามากขึ้น (ทำให้อนุภาคที่มีพลังงานสูงมีมากขึ้น)
ข. เปลี่ยนตำแหน่งของพลังงานก่อกัมมันต์
ให้เลื่อนมาทางซ้ายมากขึ้น (ลดพลังงานก่อกัมมันต์ลง)
คำตอบคือ ถูกทั้งข้อ ก และ ข
![]() ถ้าเราอยากทำให้การเปลี่ยนแปลงเป็นไปตามข้อ ก หรือ ข จะทำอย่างไร
ถ้าเราอยากทำให้การเปลี่ยนแปลงเป็นไปตามข้อ ก หรือ ข จะทำอย่างไร
ข้อ ก เปลี่ยนรูปร่างของกราฟให้โย้ไปทางขวามากขึ้นด้วยการเพิ่มอุณหภูมิ (ดูปัจจัยที่มีผลต่ออัตราการเกิดปฏิกิริยา
: อุณหภูมิ)
ข้อ ข เปลี่ยนตำแหน่งของพลังงานก่อกัมมันต์
ให้เลื่อนมาทางซ้ายมากขึ้นด้วยการเติมตัวเร่งปฏิกิริยา (ดูปัจจัยที่มีผลต่ออัตราการเกิดปฏิกิริยา:
ตัวเร่งปฏิกิริยา)