![]()
ปฏิกิริยาอันดับหนึ่ง (first-order reaction) คือ ปฏิกิริยาที่อัตราการเกิดปฏิกิริยาขึ้นอยู่กับความเข้มข้นของสารตั้งต้นยกกำลังหนึ่ง
| ปฏิกิริยา | ||
| อัตราการเกิดปฏิกิริยา | ||
| จัดสมการใหม่เป็น | 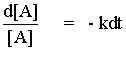 |
|
| ทำการอินทิเกรตจาก t = 0 ถึง t = t | 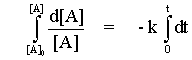 |
|
จะได้ (เมื่อ [A]0 เป็นความเข้มข้นของ A ที่เวลา t = 0) |
||
| หรือ | 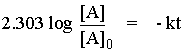 |
|
|
||
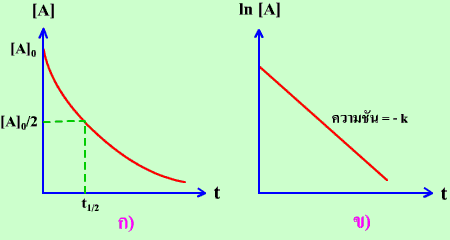
กราฟแสดงลักษณะเฉพาะตัวของปฏิกิริยาอันดับหนึ่ง ก) กราฟแสดงความสัมพันธ์ระหว่าง [A] กับ t ข) กราฟแสดงความสัมพันธ์ระหว่าง ln [A] กับ t
|
||
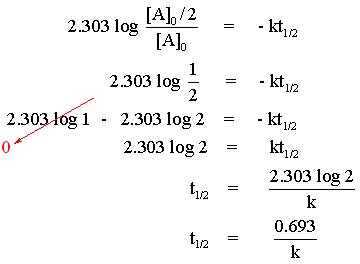 |
||