![]()
เราทราบกันดีอยู่แล้วว่า ปฏิกิริยาเอกพันธุ์ (homogeneous reaction) คือ ปฏิกิริยาที่ทั้งสารตั้งต้นและสารผลิตภัณฑ์อยู่ในวัฏภาค (phase) เดียวกัน ดังนั้น การเร่งปฏิกิริยาเอกพันธุ์ (homogeneous catalysis) ก็จะต้องใช้ตัวเร่งปฏิกิริยาที่มีวัฏภาคเดียวกันกับทั้งสารตั้งต้นและสารผลิตภัณฑ์
![]() ปฏิกิริยาเอกพันธุ์ส่วนมากจะเป็นวัฏภาคของเหลว เช่น การเร่งปฏิกิริยาด้วยกรดหรือเบสในสารละลายที่เป็นของเหลว
ปฏิกิริยาเอกพันธุ์ส่วนมากจะเป็นวัฏภาคของเหลว เช่น การเร่งปฏิกิริยาด้วยกรดหรือเบสในสารละลายที่เป็นของเหลว
ตัวอย่าง ปฏิกิริยาไฮโดรไลซิส (hydrolysis) ของเอทิลแอซิเตต (ethyl acetate) ในน้ำ
![]()
ถ้าไม่มีตัวเร่งปฏิกิริยา ปฏิกิริยาจะเกิดขึ้นช้ามาก และมีกฎอัตราเป็นดังนี้
r = [CH3COOCH2CH3]
แต่เมื่อเร่งปฏิกิริยาด้วยกรดไฮโดรคลอริก กฎอัตราก็จะเปลี่ยนเป็น
r = kc[CH3COOCH2CH3][H+] (เมื่อ kc >> k)
![]() นอกจากนี้การเร่งปฏิกิริยาเอกพันธุ์อาจเกิดในวัฏภาคแก๊สก็ได้
นอกจากนี้การเร่งปฏิกิริยาเอกพันธุ์อาจเกิดในวัฏภาคแก๊สก็ได้
ตัวอย่าง กระบวนการหลักที่ใช้ในการผลิตกรดซัลฟิวริก (sulfuric acid) จากกำมะถัน (sulphur) ที่เราเรียกว่า กระบวนการห้องตะกั่ว (lead chamber process)
![]() ถ้าไม่มีตัวเร่งปฏิกิริยา กระบวนการผลิตกรดซัลฟิวริกก็จะเกิดตามขั้นตอน ดังนี้
ถ้าไม่มีตัวเร่งปฏิกิริยา กระบวนการผลิตกรดซัลฟิวริกก็จะเกิดตามขั้นตอน ดังนี้
![]() ถ้าเติมไนโตรเจนไดออกไซด์ (nitrogen dioxide, NO2) ] ลงไปเป็นตัวเร่งปฏิกิริยา
กระบวนการผลิตกรดซัลฟูริกจะเกิดตามขั้นตอน ดังนี้
ถ้าเติมไนโตรเจนไดออกไซด์ (nitrogen dioxide, NO2) ] ลงไปเป็นตัวเร่งปฏิกิริยา
กระบวนการผลิตกรดซัลฟูริกจะเกิดตามขั้นตอน ดังนี้
![]()
จะเห็นได้ว่า NO2 จะถูกใช้ไปในปฏิกิริยาแรกและก็หมุนเวียนกลับมาในปฏิกิริยาที่สอง ทำให้ในปฏิกิริยารวมไม่มี NO2 อยู่ แสดงว่า NO2 ทำหน้าที่เป็นตัวเร่งปฏิกิริยาจริง
![]() การเร่งปฏิกิริยาเอกพันธุ์มีข้อดีหลายประการ เช่น
การเร่งปฏิกิริยาเอกพันธุ์มีข้อดีหลายประการ เช่น
1. การเร่งปฏิกิริยาเอกพันธุ์มักเกิดขึ้นได้ภายใต้สภาวะปกติ ทำให้ค่าใช้จ่ายในการผลิตต่ำ
2. ลดปัญหาเกี่ยวกับการสลายตัวของสารผลิตภัณฑ์ (สารบางตัวอาจสลายตัวที่อุณหภูมิสูง ซึ่งการเร่งปฏิกิริยาเอกพันธุ์เกิดปฏิกิริยาที่อุณหภูมิไม่สูงมากนัก)
3. สามารถออกแบบตัวเร่งปฏิกิริยาให้เลือกเร่งเฉพาะปฏิกิริยาที่ต้องการได้
4. ตัวเร่งมีราคาไม่ค่อยแพงเมื่อเทียบกับโลหะที่ใช้ในการเร่งปฏิกิริยาวิวิธพันธุ์ เช่น แพลทินัม (platinum) และทองคำ (gold)
![]() ลองทำนายปฏิกิริยานี้ซิว่า ต้องอาศัยตัวเร่งปฏิกิริยาหรือไม่
ลองทำนายปฏิกิริยานี้ซิว่า ต้องอาศัยตัวเร่งปฏิกิริยาหรือไม่
![]()
คงเห็นแล้วว่า S2O82- กับ I- ซึ่งเป็นไอออนลบทั้งคู่ การที่จะเกิดการชนกันแล้วเกิดปฏิกิริยาย่อมเป็นไปได้ยาก ดังนั้น การที่จะเกิดปฏิกิริยาได้ต้องมีตัวช่วย ซึ่งตัวช่วยในที่นี้ก็คือ ไอร์ออน(II)ไอออน; Fe2+ หรือ ไอร์ออน(III)ไอออน; Fe3+ ซึ่งทำหน้าที่เป็นตัวเร่งปฏิกิริยา
ถ้าใช้ Fe2+ ปฏิกิริยาที่เกิดขึ้น คือ
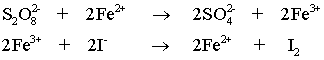
![]() ถ้าเราใช้ Fe3+ เป็นตัวเร่งปฏิกิริยา ปฏิกิริยาที่เกิดขึ้นจะเป็นอย่างไร
ถ้าเราใช้ Fe3+ เป็นตัวเร่งปฏิกิริยา ปฏิกิริยาที่เกิดขึ้นจะเป็นอย่างไร