![]()
ในการเกิดปฏิกิริยาทั่วไป ต้องมีการชนกันของอนุภาคของสารที่เข้าทำปฏิกิริยาจึงจะเกิดเป็นสารใหม่ ถ้าเป็นปฏิกิริยาที่ไม่ซับซ้อน หรือพลังงานหลังการชนกันของอนุภาคสูงกว่าพลังงานก่อกัมมันต์ ปฏิกิริยานั้นก็อาจจะเกิดได้ในขั้นตอนเดียว เช่น แก๊สไซยาโนเจน (CN) 2 โมเลกุลเกิดการชนกันแล้วเกิดเป็นแก๊ส C2 1 โมเลกุลและแก๊ส N2 1 โมเลกุล
แต่ปฏิกิริยาจำนวนมาก มักมีการชนกันหลายขั้นจึงจะได้ผลิตภัณฑ์ เช่น ปฏิกิริยาระหว่างไนตริกออกไซด์ (NO) กับออกซิเจน (O2)
![]()
จากการศึกษาพบว่ามีแก๊ส N2O2 เกิดขึ้นในขณะทำปฏิกิริยา แสดงว่าการชนไม่ได้เกิดขึ้นเพียงขั้นตอนเดียวแล้วได้เป็น NO2 แต่เกิดผ่าน 2 ขั้นตอน ดังนี้

![]() เรียกขั้นตอนย่อยที่เกิดขึ้นว่า ปฏิกิริยาย่อย
(elementary reaction) ซึ่งแสดงการเกิดปฏิกิริยาระดับโมเลกุล
เรียกขั้นตอนย่อยที่เกิดขึ้นว่า ปฏิกิริยาย่อย
(elementary reaction) ซึ่งแสดงการเกิดปฏิกิริยาระดับโมเลกุล
![]() เรียกการแสดงขั้นตอนย่อยที่เกิดขึ้นตามลำดับว่า กลไกของปฏิกิริยา
(reaction mechanism)
เรียกการแสดงขั้นตอนย่อยที่เกิดขึ้นตามลำดับว่า กลไกของปฏิกิริยา
(reaction mechanism)
![]() เรียก N2O2 ที่เกิดขึ้นในปฏิกิริยาว่าเป็น สารมัธยันตร์
(intermediate) ซึ่งหมายถึงสารที่เกิดขึ้นในปฏิกิริยาแต่ไม่ปรากฏในสมการรวม
เราจะเห็นได้ว่า สารมัธยันตร์จะเกิดในขั้นแรกๆ แล้วถูกใช้ในขั้นต่อๆ ไปขั้นใดขั้นหนึ่ง
เรียก N2O2 ที่เกิดขึ้นในปฏิกิริยาว่าเป็น สารมัธยันตร์
(intermediate) ซึ่งหมายถึงสารที่เกิดขึ้นในปฏิกิริยาแต่ไม่ปรากฏในสมการรวม
เราจะเห็นได้ว่า สารมัธยันตร์จะเกิดในขั้นแรกๆ แล้วถูกใช้ในขั้นต่อๆ ไปขั้นใดขั้นหนึ่ง
![]() จำนวนโมเลกุลของสารตั้งต้นในปฏิกิริยาย่อยเรียกว่า โมเลกุลาริตี
(molecularity) ของกระบวนการนั้น
จำนวนโมเลกุลของสารตั้งต้นในปฏิกิริยาย่อยเรียกว่า โมเลกุลาริตี
(molecularity) ของกระบวนการนั้น
-
ถ้าในปฏิกิริยาย่อยมีสารตั้งต้นที่เกี่ยวข้องเพียง 1 โมเลกุล จะเรียกว่าเป็นกระบวนการแบบหนึ่งโมเลกุล
(unimolecular)
-
ถ้าในปฏิกิริยาย่อยมีสารตั้งต้นที่เกี่ยวข้อง 2 โมเลกุล จะเรียกว่าเป็นกระบวนการแบบสองโมเลกุล
(bimolecular)
-
ถ้าในปฏิกิริยาย่อยมีสารตั้งต้นที่เกี่ยวข้อง 3 โมเลกุล จะเรียกว่าเป็นกระบวนการแบบสามโมเลกุล
(termolecular)
จะเห็นได้ว่าปฏิกิริยาระหว่างไนตริกออกไซด์ (NO) กับออกซิเจน (O2) ที่กล่าวมาแล้วเป็นกระบวนการแบบสองโมเลกุล (bimolecular) เพราะทั้งสองปฏิกิริยาย่อยมีสารตั้งต้นชนกันสองโมเลกุล
![]() ในการศึกษากลไกการเกิดปฏิกิริยานั้นเราจะเริ่มจากการวัดอัตราการเกิดปฏิกิริยา
และนำข้อมูลมาวิเคราะห์เพื่อหาค่าคงที่อัตราและอันดับของปฏิกิริยา เขียนเป็นกฎอัตรา
แล้วจึงเสนอกลไกของปฏิกิริยาในรูปของปฏิกิริยาย่อย โดยยึดหลักการ 3 ข้อ ดังนี้
ในการศึกษากลไกการเกิดปฏิกิริยานั้นเราจะเริ่มจากการวัดอัตราการเกิดปฏิกิริยา
และนำข้อมูลมาวิเคราะห์เพื่อหาค่าคงที่อัตราและอันดับของปฏิกิริยา เขียนเป็นกฎอัตรา
แล้วจึงเสนอกลไกของปฏิกิริยาในรูปของปฏิกิริยาย่อย โดยยึดหลักการ 3 ข้อ ดังนี้
1.
เมื่อรวมปฏิกิริยาย่อยทั้งหมดแล้วต้องได้เป็นสมการแสดงปฏิกิริยารวม
2.
ปฏิกิริยาย่อยที่เกิดขึ้นช้าที่สุดในกลไกการเกิดปฏิกิริยาที่เรียกว่า ขั้นกำหนดอัตรา
(rate-determining step) นั้นจะต้องให้กฎอัตราเหมือนกับกฎอัตราที่ได้จากการทดลอง
3.
ต้องมีวิธีการตรวจสอบว่า สารมัธยันตร์ในปฏิกิริยาย่อยแต่ละขั้นเกิดขึ้นจริง
ตอนนี้เรามาดูความสัมพันธ์ระหว่างกฎอัตรากับกลไกการเกิดปฏิกิริยากันบ้าง ว่าจะมีความสัมพันธ์กันอย่างไร
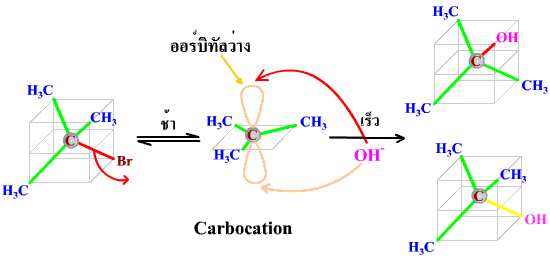
ตัวอย่าง 1 (CH3)3CBr + OH- ---------> ( CH3)3COH + Br-
นี่คือสมการสุทธิหรือสมการรวมที่เกิดจากการรวมปฏิกิริยาย่อยมาแล้ว ปฏิกิริยาย่อยของสมการนี้มีสองปฏิกิริยา คือ
| หมายเหตุ : | ในความเป็นจริงมุมระหว่างพันธะแต่ละพันธะไม่ได้เป็น 109.5 o (มุมระหว่างพันธะแต่ละพันธะของ CH4 เป็น 109.5 o ) เพราะว่าหมู่ที่มาเกาะอยู่ไม่เหมือนกันทุกหมู่ |
ขั้นตอนของการเกิดปฏิกิริยาที่เกิดขึ้นตามลำดับนี้ก็คือ กลไกของการเกิดปฏิกิริยานั่นเอง สารที่เกิดขึ้นในปฏิกิริยาย่อยโดยไม่ปรากฏในสมการรวมนี้เรียกว่า สารมัธยันตร์ ซึ่งสารเหล่านี้สามารถวิเคราะห์หรือยืนยันได้ว่ามีอยู่จริง ดังนั้น เราก็สามารถบอกได้ว่าในปฏิกิริยานี้มีสารใดเป็นสารมัธยันตร์
ปฏิกิริยาย่อยขั้นแรกเป็นขั้นที่เกิดช้า ซึ่งเราเรียกว่า ขั้นกำหนดอัตรา เพราะค่า Ea ของการเกิด (CH3)3C+ มีค่าสูง จึงทำให้ (CH3)3C+ เกิดขึ้นได้ช้า ส่วนอัตราการเกิดปฏิกิริยาขั้นที่สองนั้นจะเร็วกว่ามาก ดังนั้นอัตราการเกิดปฏิกิริยาของปฏิกิริยารวมที่เราวัดได้จึงมาจากอัตราการเกิดปฏิกิริยาของปฏิกิริยาย่อยในขั้นที่หนึ่งนั่นเอง
เมื่อทดลองหาอัตราการเกิดปฏิกิริยา ได้กฎอัตราดังนี้
rate = k [(CH3)3CBr]
แสดงว่าอัตราการเกิดปฏิกิริยาของขั้นกำหนดอัตราเป็นอัตราการเกิดปฏิกิริยาของปฏิกิริยานี้ โดยเป็นปฏิกิริยาอันดับ 1 เมื่อเทียบกับสาร (CH3)3CBr และ เป็นปฏิกิริยาอันดับ 0 เมื่อเทียบกับ OH- และอันดับรวมของปฏิกิริยาเป็น 1 หรือสรุปได้ว่าอัตราการเกิดปฏิกิริยานี้ขึ้นอยู่กับสาร (CH3)3CBr เพียงชนิดเดียว การเพิ่ม OH- ไม่มีผลต่ออัตราการเกิดปฏิกิริยา
มาถึงตรงนี้ คงจะเห็นความสอดคล้องกันของกฎอัตราและกลไกการเกิดปฏิกิริยาแล้วไช่ไหม ถ้าเช่นนั้นลองมาดูตัวอย่างที่สองเปรียบเทียบกับตัวอย่างที่หนึ่ง
ตัวอย่าง 2 CH3CH2Br + OH- -------> CH3CH2OH + Br-
จากการทดลองได้กฎอัตราดังนี้
rate = k [CH3CH2Br][OH-]
![]() เมื่อกฎอัตราเป็นเช่นนี้ กลไกของปฏิกิริยาน่าจะเหมือนหรือแตกต่างจากตัวอย่างแรก
เมื่อกฎอัตราเป็นเช่นนี้ กลไกของปฏิกิริยาน่าจะเหมือนหรือแตกต่างจากตัวอย่างแรก
คำตอบก็คือ กลไกของปฏิกิริยาต้องไม่เหมือนกับตัวอย่างแรกอย่างแน่นอน ปฏิกิริยาควรจะเกิดจากการที่สารทั้งสองเข้าชนหรือเข้าทำปฏิกิริยากันโดยตรง ดังนี้

| หมายเหตุ : | ในความเป็นจริงมุมระหว่างพันธะแต่ละพันธะไม่ได้เป็น 109.5 o (มุมระหว่างพันธะแต่ละพันธะของ CH4 เป็น 109.5 o ) เพราะว่าหมู่ที่มาเกาะอยู่ไม่เหมือนกันทุกหมู่ |
สมการที่ยกตัวอย่างมานี้พบได้ในเคมีอินทรีย์ ซึ่งเรียกกลไกปฏิกิริยาที่เกิดในลักษณะของตัวอย่างที่ 1 ว่า SN1 (unimolecular nucleophilic substitution) และตัวอย่างที่ 2 ว่า SN2 (bimolecular nucleophilic substitution)
คงเห็นแล้วว่า ปฏิกิริยาทั้งสองซึ่งเป็นปฏิกิริยาระหว่างสารประกอบอัลคิลโบรไมด์(alkyl bromide)กับไฮดรอกไซด์ไอออนเหมือนกัน แต่มีกลไกการเกิดปฏิกิริยาต่างกัน ดังนั้น ถ้าเราต้องการทำให้ปฏิกิริยาในตัวอย่างที่ 1 เกิดเร็วขึ้น เราก็จะไม่เสียสารตั้งต้นหรือเสียเวลาในการเพิ่มความเข้มข้นของเพราะความเข้มข้นของ OH- ไม่มีผลต่ออัตราการเกิดปฏิกิริยา