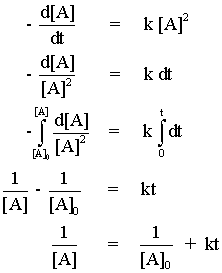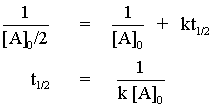![]()
ปฏิกิริยาอันดับสอง (second-order reaction) คือ ปฏิกิริยาที่อัตราการเกิดปฏิกิริยาขึ้นอยู่กับความเข้มข้นของสารตั้งต้นยกกำลังสอง หรือขึ้นอยู่กับความเข้มข้นของสารตั้งต้นสองชนิด แต่ละชนิดยกกำลังหนึ่ง
| อัตราการเกิดปฏิกิริยา | |
จากวิธีทางแคลคูลัส จะได้ว่า |
|
|
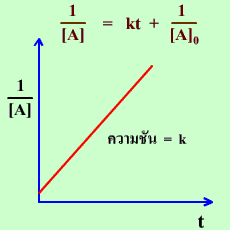
กราฟแสดงความสัมพันธ์ระหว่าง 1/[A] กับ t สำหรับปฏิกิริยาอันดับสอง
|
สำหรับปฏิกิริยาอันดับสอง เราสามารถหาครึ่งชีวิตได้โดยการแทนค่า [A] = [A]0/2 ลงในสมการ จะได้
จะสังเกตได้ว่า ค่าครึ่งชีวิตของปฏิกิริยาอันดับสองมีค่าขึ้นอยู่กับความเข้มข้นเริ่มต้นของสารตั้งต้น ซึ่งแตกต่างจากค่าครึ่งชีวิตของปฏิกิริยาอันดับหนึ่ง เราจึงสามารถบอกความแตกต่างของปฏิกิริยาอันดับหนึ่งและอันดับสองโดยใช้ครึ่งชีวิตได้ |
|
| อัตราการเกิดปฏิกิริยา | |
อันดับรวมของปฏิกิริยานี้เป็นอันดับสอง หรือเราอาจบอกว่า เป็นปฏิกิริยาอันดับหนึ่งเมื่อเทียบกับสาร A หรือ B ก็ไม่ผิด หมายเหตุ : ในที่นี้จะไม่ขอกล่าวถึงรายละเอียดของปฏิกิริยาที่มีสารตั้งต้นตั้งแต่สองชนิดขึ้นไป เพราะจะมีความซับซ้อนมาก |
|