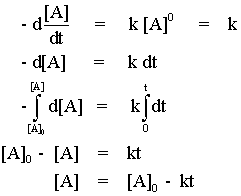![]()
ปฏิกิริยาอันดับหนึ่งและปฏิกิริยาอันดับสองเป็นปฏิกิริยาที่พบมากที่สุด ส่วนปฏิกิริยาอันดับศูนย์ (zero order) นั้นมีไม่มากนัก ปฏิกิริยาอันดับศูนย์เป็นปฏิกิริยาที่ศึกษาได้ง่ายเพราะมีกฎอัตราเป็นดังนี้
r = k[A]0 = k
ดังนั้น ปฏิกิริยาชนิดนี้จึงมีอัตราการเกิดคงที่เสมอ ไม่ขึ้นกับความเข้มข้นของสารตั้งต้น
ตัวอย่าง การสลายตัวของ NH3 บนผิวของโมลิบดีนัม (ตัวเร่งปฏิกิริยา) การเพิ่มความดัน (เพิ่มความเข้มข้น) ของแก๊สไม่ได้ช่วยเพิ่มอัตราการเกิดปฏิกิริยา ซึ่งเราจะเรียกว่า เป็นปฏิกิริยาอันดับศูนย์ (zero-order reaction)
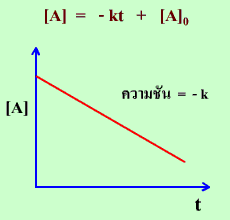
จะเห็นได้ว่า อัตราการเกิดปฏิกิริยาจะคงที่ตลอดเวลาที่เกิดปฏิกิริยา ถ้าเราเขียนกราฟแสดงความสัมพันธ์ระหว่าง [A] กับ t ก็จะได้กราฟเป็นเส้นตรงที่มีความชัน -k
|
กราฟแสดงความสัมพันธ์ระหว่าง
[A] กับ t |
สำหรับปฏิกิริยาอันดับศูนย์ เราสามารถหาครึ่งชีวิตได้โดยการแทนค่า [A] = [A]0/2 ลงในสมการ จะได้
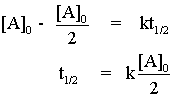
จะสังเกตได้ว่า ค่าครึ่งชีวิตของปฏิกิริยาอันดับศูนย์แตกต่างจากค่าครึ่งชีวิตของปฏิกิริยาอันดับหนึ่งและอันดับสอง เราจึงสามารถบอกความแตกต่างของปฏิกิริยาอันดับศูนย์จากปฏิกิริยาหนึ่งและอันดับสองโดยใช้ครึ่งชีวิตได้