| |
1. สมบัติของเหลว
1.3 ความดันไอ (vapor pressure)
พิจารณารูปต่อไปนี้ สมมติว่า ในภาชนะ ซึ่งเป็นหลอดแก้วปิด บรรจุของเหลวชนิดหนึ่ง
โดยทั่วไป เมื่อของเหลวหนึ่งๆ บรรจุอยู่ใน ภาชนะเปิด เมื่อทิ้งไว้ระยะหนึ่ง จะเห็นว่า ในที่สุดของเหลวนี้จะระเหยไปหมด ไม่มีของเหลวเหลืออยู่ แต่ถ้านำของเหลวไปบรรจุใน ภาชนะปิด โดยวางภาชนะนี้ไว้ในที่สภาวะเดียวกัน มีอุณหภูมิ และความดันเดียวกัน เมื่อทิ้งไว้ในระยะเวลาหนึ่งจะพบว่า มีไอซึ่งเกิดจากการระเหยปรากฏอยู่เหนือของเหลวนี้ ไอของโมเลกุลของเหลวที่อยู่เหนือของเหลวนี้จะวิ่งชนกับผนังของภาชนะ จึงทำให้เกิดความดัน เราเรียกว่า ความดันไอ (vapor pressure)
a)โมเลกุลของเหลวเริ่มระเหย |
|
b)โมเลกุลของเหลว เริ่มระเหยมากขึ้น |
|
c) มีการระเหยมากขึ้นเรื่อยๆ พร้อม กับมีการควบแน่นบางส่วนของโมเลกุล |
| |
------ เวลาเพิ่มขึ้น ------> |
ในรูป a โมเลกุลจะเริ่มระเหยกลายเป็นไอ และในรูป b การระเหยจะมากขึ้น และในรูป c โมเลกุลของของเหลวระเหยมาก แต่ก็มีโมเลกุลของเหลวบางส่วนที่สามารถควบแน่นกลับมาเป็นของเหลวได้ ถ้าอัตราการระเหยเท่ากับอัตราการควบแน่น จะเรียกว่า ของเหลวอยู่ในภาวะสมดุลกับไอ
ลองพิจารณารูปต่อไปนี้
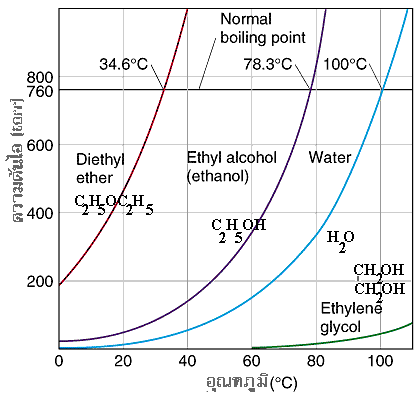
กราฟแสดงความสัมพันธ์ระหว่างอุณหภูมิกับความดันไอของของเหลวชนิดต่างๆ |
ของเหลวแต่ละชนิดจะมีความดันไอไม่เท่ากัน โดยทั่วไป พบว่าถ้าแรงดึงดูดระหว่างโมเลกุลน้อย ความดันไอของของเหลวจะมีค่าสูง เพราะโมเลกุลของของเหลวสามารถระเหยได้ง่าย ในทางตรงกันข้าม ถ้าของเหลวมีแรงดึงดูดระหว่างโมเลกุลมาก ความดันไอของของเหลวก็จะมีค่าน้อย จากกราฟ ถ้าพิจารณาความสัมพันธ์ในแง่ของความสัมพันธ์ระหว่างความหนืดกับความดันไอ ผลที่ได้ ก็จะมีแนวโน้มเหมือนกับแรงดึงดูดระหว่างโมเลกุล พบว่า ถ้าความหนืดของของเหลวมาก ความดันไอจะต่ำ และในทางกลับกัน ถ้าความหนืดของของเหลวน้อย ความดันไอก็จะสูง ่ ดังนั้น จากกราฟ เราสามารถเรียงความดันไอลำดับของสารต่างๆ ได้ดังนี้ diethyl ether > ethyl alcohol > water > ethylene glycol หรือในทางตรงกันข้าม ถ้าเรียงลำดับความหนืดของของเหลว จะเป็น ethylene glycol > water > ethyl alcohol > diethyl ether ตามลำดับ |