![]()
เทคนิควิเคราะห์โพเทนชิออเมทรี
- การวัดศักย์โดยตรง (Direct)
- การเติมสารมาตรฐานในสารละลายตัวอย่าง
(Standard additions)
- การวัดศักย์ไทเทรต (Titration)
การวัดศักย์โดยตรง (Direct Potentiometric Measurements)
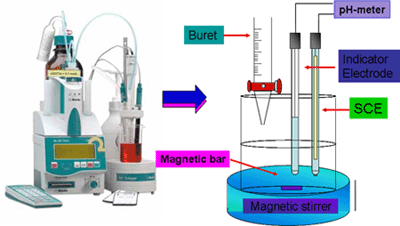
การวัดศักย์โดยตรง เป็นวิธีที่คุ้นเคยและใช้กันมากที่สุด วิธีการสำหรับการวัดศักย์โดยตรง แสดงได้ดังรูป
หลักการของวิธีนี้คือเปรียบเทียบศักย์ที่เกิดขึ้นในเซลล์ของขั้วไฟฟ้าใช้งานที่จุ่มอยู่ในสาระละลายตัวอย่างกับค่าศักย์ที่ได้เมื่อจุ่มขั้วไฟฟ้าลงในสารละลายมาตรฐาน ที่ทราบความเข้มข้นแน่นอน สมการที่เกี่ยวข้องกับการวัดศักย์โดยตรง คือ
Ecell = Eind Eref + Ej
| เมื่อ | Ecell |
= ศักย์เซลล์ |
Eind |
= ศักย์ที่วัดได้จากขั้วแคโทด | |
Eref |
= ศักย์ที่วัดได้จากขั้วแอโนด | |
Ej |
= ศักย์รอยต่อ |
การเติมสารมาตรฐานในสารละลายตัวอย่าง (Standard addition Method)
เป็นการศึกษาค่าศักย์ที่เกิดขึ้นกับขั้วไฟฟ้า ทั้งก่อนและหลังที่เติมสารมาตรฐานที่ทราบปริมาตรลงในสารละลายตัวอย่างที่ทราบปริมาตรแน่นอนเช่นกัน โดยสารละลายตัวอย่างต้องเติมสารอิเล็กโทรไลต์ที่เฉื่อยมากพอ เพื่อควบคุมความแรงของไอออนของสารละลายทั้งก่อนและหลังเติมสารมาตรฐานไม่ให้ต่างกัน และทั้งนี้ค่าศักย์รอยต่อสารละลาย (Ej) เมื่อเติมสารละลายมาตรฐาน และเมื่อยังไม่เติมมีค่าไม่เปลี่ยนแปลง
การวัดศักย์ไทเทรต (Potentiometric Titrations)
การวิเคราะห์โดยวิธีนี้ เป็นการใช้ขั้วไฟฟ้าแบบเจาะจงไอออนเป็นการวัดการดำเนินไปของปฏิกิริยาที่เกิดจากการไทเทรต
โดยทั่วไปแล้วในเทคนิคนี้ ไทแทรนต์ (titrant) ที่ใช้สามารถเกิดเป็นสารเชิงซ้อนหรือทำปฏิกิริยากับไอออนของสารตัวอย่าง
จากปริมาตรของไทแทรนต์ที่ใช้ สามารถคำนวณกลับแล้วระบุเป็นค่าความเข้มข้นของไอออนได้
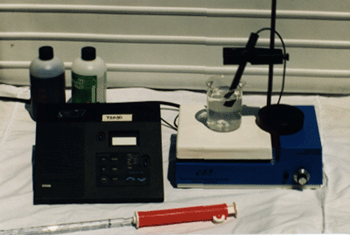
การจัดอุปกรณ์สำหรับวิธีการวิเคราะห์โดยการวัดศักย์ไทเทรตแสดงได้ดังรูป