"ไฟฟ้าเคมี" เป็นความสัมพันธ์ระหว่างปฏิกิริยาเคมีและพลังงานไฟฟ้า ซึ่งกระบวนการทางไฟฟ้าเคมีจะเกิดจากการถ่ายโอนอิเล็กตรอนจากสารหนึ่งไปยังสารหนึ่ง และเมื่อมีการถ่ายโอนอิเล็กตรอน ปฏิกิริยาเคมีก็จะสามารถทำให้เกิดพลังงานไฟฟ้าได้ ในทำนองกลับกันพลังงานไฟฟ้าก็สามารถทำให้เกิดปฏิกิริยาเคมีได้เช่นกัน ปฏิกิริยาที่มีการถ่ายโอนอิเล็กตรอนนี้เรียกว่า ปฏิกิริยารีดอกซ์ (Redox Reaction)
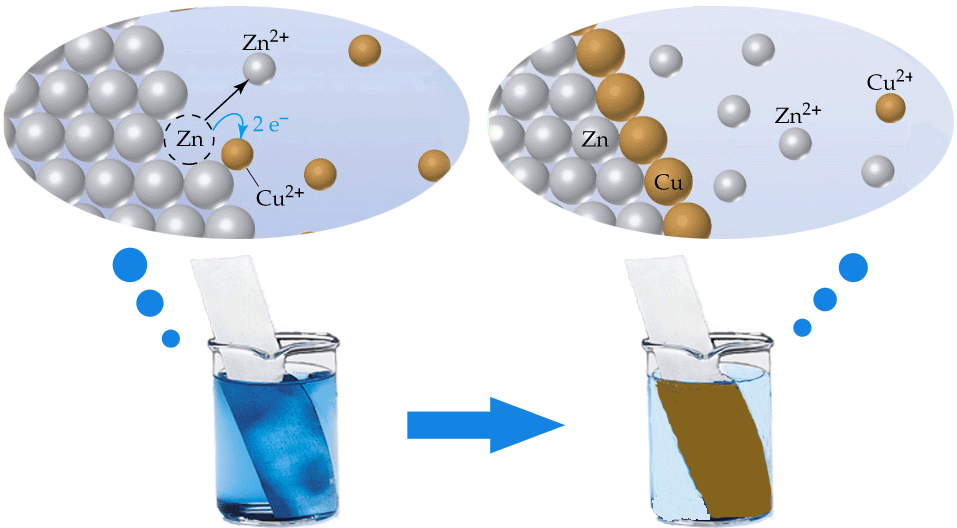
ปฏิกิริยารีดอกซ์ หรือปฏิกิริยาออกซิเดชัน-รีดักชัน (Oxidation-Reduction Reaction) จะเกิดสองปฏิกิริยาย่อยควบคู่กันไปเสมอ นั่นคือ ปฏิกิริยาออกซิเดชัน (Oxidation Reaction) และ ปฏิกิริยารีดักชัน (Reduction Reaction) ปฏิกิริยารีดอกซ์ส่วนมากจะเกิดขึ้นเองตามธรรมชาติ เช่น การนำโลหะสังกะสี (Zn) จุ่มลงไปในสารละลายของทองแดง (Cu2+) ดังรูป
ปฏิกิริยาที่เกิดขึ้นเป็นไปตามสมการ
อิเล็กตรอนจะถูกถ่ายโอนจาก Zn ไปยัง Cu2+ ในสารละลายได้โดยตรง สิ่งที่จะสังเกตเห็นได้ชัดเจนก็คือ แผ่นสังกะสีจะกร่อน มีตะกอนของทองแดงเกิดขึ้นบนแผ่นสังกะสี และเมื่อตั้งทิ้งไว้สารละลายสีฟ้าของ Cu2+ จะค่อย ๆ เปลี่ยนเป็นไม่มีสี โดยเกิดปฏิกิริยาย่อย หรือที่เรียกว่าครึ่งปฏิกิริยา (half-reaction) คือ ปฏิกิริยาออกซิเดชัน เป็นปฏิกิริยาที่มีการให้อิเล็กตรอน โดย Zn ให้อิเล็กตรอนแล้วกลายเป็น Zn2+
Zn(s) ปฏิกิริยารีดักชันเป็นปฏิกิริยาที่มีการรับอิเล็กตรอน โดย Cu2+ รับอิเล็กตรอนแล้วกลายเป็นอะตอมของ Cu Cu2+(aq)
+ 2e- Cu2+ เมื่อรับอิเล็กตรอนแล้วมีเลขออกซิเดชันลดลงจาก +2 เป็น 0 ปฏิกิริยารีดักชันจึงเป็นปฏิกิริยาที่มีการลดลงของเลขออกซิเดชัน และอาจกล่าวว่า สารที่รับอิเล็กตรอนและมีเลขออกซิเดชันลดลง (Cu2+) นี้ถูกรีดิวซ์ เมื่อรวมปฏิกิริยา (1) และ (2) จะได้ปฏิกิริยาดังสมการ Zn(s)
+ Cu2+(aq) ปฏิกิริยา (3) เรียกว่า ปฏิกิริยาออกซิเดชัน-รีดักชัน หรือหรือเรียกสั้นๆ ว่า ปฏิกิริยารีดอกซ์ โดย Zn รีดิวซ์ Cu2+ ให้เป็น Cu และ Cu2+ ออกซิไดซ์ Zn ให้กลายเป็น Zn2+ หรืออาจกล่าวว่า Cu2+ ถูกรีดิวซ์โดย Zn และ Zn ถูกออกซิไดซ์โดย Cu2+ Zn จึงเป็นตัวรีดิวซ์ (reducing agent) และ Cu2+ เป็นตัวออกซิไดซ์ (oxidizing agent) ตัวอย่างปฏิกิริยารีดอกซ์เพิ่มเติม
บอกได้หรือไม่ว่าแต่ละปฏิกิริยามีสารใดเป็นตัวรีดิวซ์ และสารใดเป็นตัวออกซิไดซ์์ ***
การรวมปฏิกิริยาต้องตรวจสอบจำนวนอิเล็กตรอนที่ให้และที่รับของทั้งสองครึ่งปฏิกิริยาให้เท่ากันก่อน
LAnOx vs GRedCat LAnOx: Lose electrons/mass: Anode: Oxidized(Oxidation) GRedCat: Gain electrons/mass: Reduced(Reduction): Cathode
|
|||||||||||||||||||||||||||