![]()
จากเซลล์ไฟฟ้า Zn-Cu เมื่อใช้ความเข้มข้นของไอออนของสารละลายในแต่ละครึ่งเซลล์เท่ากับ 1.0 M ที่ 25 ๐C เซลล์ไฟฟ้านี้จะมี emf เท่ากับ 1.10 V ถ้าทราบศักย์ไฟฟ้าของอิเล็กโทรดใดอิเล็กโทรดหนึ่งแล้วนำไปลบออกจาก 1.10 V ก็จะทราบค่าของอิเล็กโทรดหนึ่ง แต่ในทางปฏิบัติไม่สามารถวัดศักย์ไฟฟ้าของอิเล็กโทรดเดี่ยว ๆ ได้ จึงได้มีการกำหนดอิเล็กโทรดมาตรฐานขึ้นมา ซึ่งได้แก่ ไฮโดรเจนอิเล็กโทรดมาตรฐาน (Standard Hydrogen Electrode: SHE) ในครึ่งเซลล์ไฮโดรเจนมาตรฐานนี้ประกอบด้วย ขั้วแพลตินัม (อิเล็กโทรดเฉื่อย) สารละลายกรดไฮโดรคลอริก และแก๊สไฮโดรเจนภายใต้สภาวะมาตรฐาน (ความดันของแก๊สไฮโดรเจนเท่ากับ 1 atm ความเข้มข้นของสารละลายกรดไฮโดรคลอริกเท่ากับ 1 M และวัดที่อุณหภูมิ 25 ๐C) โดยผ่านแก๊สไฮโดรเจนในสารละลายกรดไฮโดรคลอริกตลอดเวลา จึงมีสมดุลเกิดขึ้นดังสมการ
2H+(aq)
+ 2e- ![]() H2(g)
H2(g)
ค่าศักย์มาตรฐานของครึ่งเซลล์ไฮโดรเจนมาตรฐานเท่ากับ 0.00 V ใช้สัญลักษณ์ E๐ แทนศักย์ไฟฟ้าที่สภาวะมาตรฐาน

หมายเหตุ
: ครึ่งเซลล์เป็นเหมือนอิเล็กโทรดหรือขั้ว
สามารถใช้ครึ่งเซลล์ไฮโดรเจนมาตรฐานนี้ในการหาศักย์ไฟฟ้าของอิเล็กโทรดอื่น เช่น เมื่อต่อเซลล์กัลวานิก ระหว่างครึ่งเซลล์ SHE และครึ่งเซลล์ Cu ดังรูป

จากโวลต์มิเตอร์ได้ค่าศักย์ไฟฟ้ามาตรฐานของเซลล์เท่ากับ 0.34 V โดยมีปฏิกิริยาเกิดขึ้นดังนี้
ปฏิกิริยาออกซิเดชันที่แอโนด
(SHE) H2(g)
![]() 2H+(aq)
+ 2e-
2H+(aq)
+ 2e-
ปฏิกิริยารีดักชันที่แคโทด
(Cu) Cu2+(aq)
+ 2e- ![]() Cu(s)
Cu(s)
จาก E๐cell = E๐cathode - E๐anode
ดังนั้น E๐cell = E๐Cu - E๐SHE
0.34 V = E๐Cu - 0.00 V
E๐Cu = 0.34 V - 0.00 V = 0.34 V
เมื่อต่อเซลล์กัลวานิกระหว่างครึ่งเซลล์ SHE และครึ่งเซลล์ Zn จะได้เป็น

อ่านค่าศักย์ไฟฟ้ามาตรฐานของเซลล์ได้เท่ากับ 0.76 V โดยมีปฏิกิริยาเกิดขึ้น ดังสมการ
ปฏิกิริยาออกซิเดชันที่แอโนด
(Zn) Zn(s)
![]() Zn2+(aq)
+ 2e-
Zn2+(aq)
+ 2e-
ปฏิกิริยารีดักชันที่แคโทด
(SHE) 2H+(aq)
+ 2e- ![]() H2(g)
H2(g)
จาก E๐cell = E๐cathode - E๐anode
ดังนั้น E๐cell = E๐SHE - E๐Zn
0.76 V = 0.00 V - E๐Zn
E๐Zn = 0.00 V 0.76 V = -0.76 V
ค่า E๐ ที่ได้เป็นค่าศักย์รีดักชันของแต่ละครึ่งเซลล์ นั่นคือ
Cu2+(aq)
+ 2e- ![]() Cu(s) E๐ = +0.34 V
Cu(s) E๐ = +0.34 V
Zn2+(aq)
+ 2e- ![]() Zn(s) E๐ = -0.76 V
Zn(s) E๐ = -0.76 V
ศักย์ไฟฟ้ารีดักชันมาตรฐานที่
25๐C (298 K)
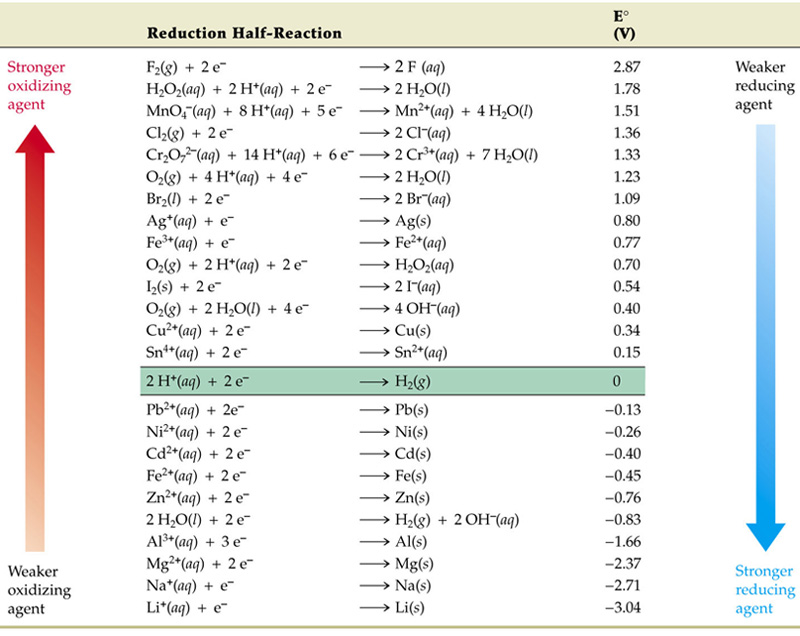
***ค่า E๐ เป็นค่าศักย์ไฟฟ้ามาตรฐานของปฏิกิริยารีดักชัน
***ค่า E๐ เป็นบวกมาก แสดงว่าตัวออกซิไดซ์ (ด้านซ้ายของสมการ) จะเป็นตัวออกซิไดซ์ที่แรง ส่วนตัวรีดิวซ์ (ด้านขวาของสมการ) จะเป็นตัวรีดิวซ์ที่อ่อน ดังนั้นสารที่อยู่ทางซ้ายของครึ่งปฏิกิริยาใด ๆ จะทำปฏิกิริยาได้เองกับสารที่อยู่ทางขวาของครึ่งปฏิกิริยาที่อยู่ถัดลงมา เช่น
Br2(l)
+ 2Ag(s) ![]() 2Br-(aq) + 2Ag+aq)
2Br-(aq) + 2Ag+aq)
***การเปลี่ยนสัมประสิทธิ์ของปฏิกิริยาครึ่งเซลล์ไม่มีผลต่อค่า E๐
***เมื่อกลับทิศทางของปฏิกิริยาเป็นปฏิกิริยาออกซิเดชัน ค่า E๐ จะมีเครื่องหมายตรงข้าม
***ปฏิกิริยารีดอกซ์ที่เกิดขึ้นได้เอง จะต้องมีค่า E๐ ของเซลล์เป็นบวกเสมอ
ตัวอย่าง
1 2Ag+(aq)
+ Mg(s) ![]() 2Ag(s)
+ Mg2+(aq)
2Ag(s)
+ Mg2+(aq)
จาก E๐cell = E๐cathode - E๐anode
= +0.80 V - (-2.37 V) = +3.17 V
ดังนั้น ปฏิกิริยานี้เกิดขึ้นได้เอง
ตัวอย่าง 2
Fe2+(aq)
+ Ni(s) ![]() Fe(s) + Ni2+(aq)
Fe(s) + Ni2+(aq)
จาก E๐cell = E๐cathode - E๐anode
= -0.44 V - (-0.25 V) = -0.19 V
ดังนั้น ปฏิกิริยานี้เกิดขึ้นเองไม่ได้ ปฏิกิริยาที่เกิดขึ้นได้เองคือ
Fe(s)
+ Ni2+(aq) ![]() Fe2+(aq) + Ni(s)
Fe2+(aq) + Ni(s)