| |
อะตอมประกอบด้วยส่วนที่สำคัญอะไรบ้าง |

ภายในเป็นที่อยู่ของอนุภาคโปรตอน (proton) ที่มีประจุบวก และนิวตรอน (neutron) ซึ่งไม่มี
ประจุยกเว้นธาตุไฮโดรเจนไม่มีนิวตรอน เลขอะตอมของธาตุ (atomic number) เท่ากับจำนวน
โปรตอนของธาตุนั้น และน้ำหนักอะตอม (mass number) เท่ากับผลรวมของจำนวนโปรตอน
และนิวตรอน นิวเคลียสของธาตุต่างไอโซโทปกันจะมีจำนวนโปรตอนเท่ากันแต่มีจำนวน
นิวตรอนแตกต่างกัน เช่น ธาตุไฮโดรเจนมี 3 ไอโซโทป คือ ไฮโดรเจน ดิวทีเรียม
(deuterium) และทริเตรียม (tritium) ซึ่งประกอบด้วยจำนวนนิวตรอนเท่ากับ 0, 1 และ 2
ตามลำดับ ดังนั้นธาตุที่มีไอโซโทปต่างกันจะมีเลขอะตอมเท่ากัน แต่น้ำหนักอะตอมแตกต่างกัน
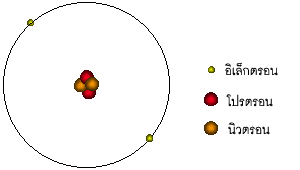
รูปที่ 2.1 โครงสร้างอะตอมของธาตุฮีเลียม
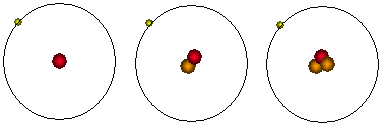
| อะตอมของธาตุไฮโดรเจน |
อะตอมของธาตุดิวทีเรียม |
อะตอมของธาตุทริเตรียม |
มี 1 โปรตอนและไม่มีนิวตรอน น้ำหนักอะตอม เท่ากับ 1 |
มี 1 โปรตอนและ 1 นิวตรอน น้ำหนักอะตอม เท่ากับ 2 |
มี 1 โปรตอนและ 2 นิวตรอน น้ำหนักอะตอม เท่ากับ 3 |
รูปที่ 2.2 โครงสร้างอะตอมของไอโซโทปไฮโดรเจน
ที่มา |
มีประจุลบและวิ่งอยู่รอบนิวเคลียสของอะตอมนั้น โดยทั่วไปจำนวนอิเล็กตรอนจะเท่ากับจำนวน
โปรตอน และอิเล็กตรอนของอะตอมจะมีปริมาณพลังงานแตกต่างกัน กล่าวคืออิเล็กตรอนที่อยู่
ู่ใกล้นิวเคลียสจะมีพลังงานน้อยกว่าอิเล็กตรอนที่อยู่ห่างจากนิวเคลียส เพราะอยู่ในชั้นระดับ
พลังงานต่ำกว่า โดยปกติอิเล็กตรอนมีแนวโน้มที่จะอยู่ในที่มีระดับพลังงานต่ำ แต่ถ้าให้พลังงาน
กับอิเล็กตรอนแล้ว อิเล็กตรอนนั้นก็จะมีระดับพลังงานที่สูงขึ้นได้ และเมื่ออิเล็กตรอนกลับมาที่
ี่ระดับพลังงานต่ำตามเดิม พลังงานก็จะถูกปลดปล่อยออกมา
โดยอะตอมจะมีสภาพเสถียร (stable) ที่สุด เมื่ออิเล็กตรอนทั้งหมดอยู่ที่ระดับพลังงานต่ำที่สุด
เท่าที่จะเป็นไปได้ ซึ่งระดับพลังงานขั้นแรกสามารถยึดอิเล็กตรอนไว้ได้ 2 อิเล็กตรอน ระดับ
พลังงานขั้นที่ 2 สามารถยึดได้ 8 อิเล็กตรอน ปฏิกิริยาเคมีระหว่างอะตอมเป็นผลมาจากการที่
อะตอมมีแนวโน้มที่จะพยายามจัดเรียงตัวให้เสถียรที่สุดเท่าที่จะเป็นไปได้