| |
โมเลกุลของสารต่างๆ เกิดขึ้นได้อย่างไร |

ที่พบในสิ่งมีชีวิตคือพันธะไอออน (ionic bond) และพันธะโคเวเลนซ์ (covalent bond)
ประจุของอะตอมเกิดขึ้นเมื่ออิเล็กตรอนกระโดดจากอะตอมหนึ่งไปสู่อะตอมอื่น อะตอมที่มี
ประจุนี้เรียกว่า อิออน ซึ่งพันธะไอออนนั้นเกิดขึ้นจากแรงดึงดูดระหว่างประจุตรงข้ามของอิออน และพันธะโคเวเลนซ์เกิดขึ้นจากการใช้คู่อิเล็กตรอนวงนอกของอะตอมร่วมกัน สำหรับพันธะ
โคเวเลนซ์พันธะเดียวมีการใช้คู่อิเล็กตรอนร่วมกัน 1 คู่ พันธะโคเวเลนซ์พันธะคู่มีการใช้
คู่อิเล็กตรอน 2 คู่ และพันธะโคเวเลนซ์พันธะสามมีการใช้คู่อิเล็กตรอน 3 คู่ ในบางกรณี
ีอาจเกิดพันธะโคเวเลนซ์แบบมีขั้ว (polar covalent bond) ซึ่งเกิดจากการใช้อิเล็กตรอน
ร่วมกันแบบไม่สมดุล เนื่องจากขนาดของอะตอมที่ทำปฏิกิริยากันมีขนาดแตกต่างกันมากทำให้
เกิดบริเวณประจุบวกและลบขึ้น
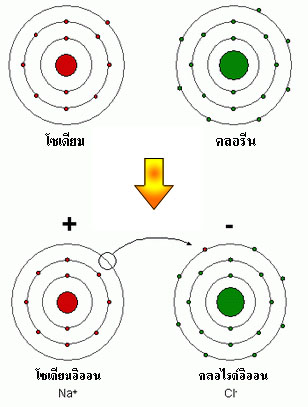
รูปที่ 2.3 การเกิดพันธะไอออนระหว่างอะตอมโซเดียมและอะตอมคลอไรด์
ที่มา |

รูปที่ 2.4 พันธะไอออนของผลึกโซเดียมคลอไรด์
(sodium chloride)
ที่มา |
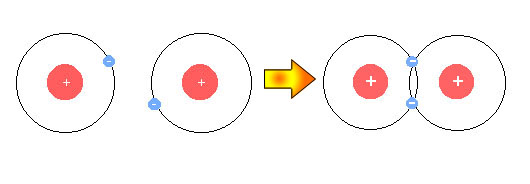
รูปที่ 2.5 การเกิดพันธะโคเวเลนซ์พันธะเดียวของอะตอมไฮโดรเจน
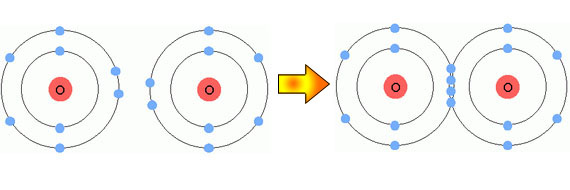
รูปที่ 2.6 การเกิดพันธะโคเวเลนซ์พันธะคู่ของอะตอมออกซิเจน
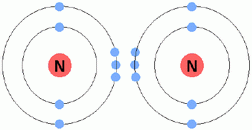
รูปที่ 2.7 การเกิดพันธะโคเวเลนซ์พันธะสามของอะตอมไนโตรเจน
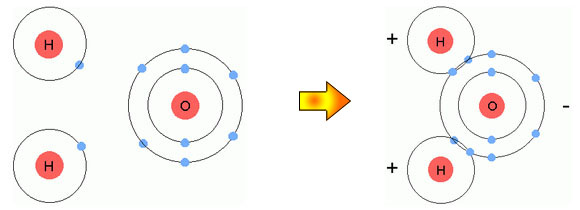
รูปที่ 2.8 การเกิดพันธะโคเวเลนซ์แบบมีขั้วของโมเลกุลน้ำ
อะตอมของธาตุมากกว่า 1 ชนิด ในสัดส่วนที่แน่นอนเรียกว่า สารประกอบ (compound)
ธาตุที่สำคัญ 6 ชนิด คือ คาร์บอน (C) ไฮโดรเจน (H) ไนโตรเจน (N) ออกซิเจน (O)
ฟอสเฟต (P) และซัลเฟอร์ (S) สามารถทำให้เกิดสารที่เป็นองค์ประกอบของสิ่งมีชีวิตถึง
ร้อยละ 99 อะตอมของธาตุเหล่านี้มีขนาดเล็ก สามารถยึดเกาะกันแน่นด้วยพันธะโคเวเลนซ์
และประกอบกันเป็นโมเลกุลที่ซับซ้อนได้มากมายในระบบสิ่งมีชีวิต