
พลังงานอิสระกำหนดทิศทางของปฏิกิริยาเคมี
ในธรรมชาติได้ โดยค่ารวมของเอนโทรปีจะเพิ่มขึ้นเสมอเมื่อมีการเปลี่ยนแปลงเกิดขึ้น
แต่ในทางชีววิทยาเมื่อต้องการทำนายว่าการเปลี่ยนแปลงใดๆ จะเกิดขึ้นได้หรือไม่และ
ยากง่ายเพียงใด การใช้เอนโทรปีเป็นตัววัดจะไม่สะดวก เพราะต้องทำการวัดการเปลี่ยนแปลง
ทั้งในระบบและสิ่งแวดล้อม ดังนั้นฟังก์ชันที่สะดวกกว่า คือ พลังงานอิสระกิบส์ (gibbs free
energy) จึงถูกนิยามขึ้นเพื่อใช้วัดการเปลี่ยนแปลงเฉพาะที่เกิดในระบบเท่านั้น
ผลต่างของพลังงานอิสระ หรือ
ของปฏิกิริยา ผลต่างพลังงานอิสระกิบส์เป็นปริมาณพลังงานที่เหลือจากการเปลี่ยนแปลง
ในระบบซึ่งเกิดขึ้นที่อุณหภูมิและความดันคงที่ และพลังงานส่วนนี้สามารถนำไปใช้ใน
การทำงานต่อได้
ที่เหลือที่ทำงานได้น้อยกว่าตัวเข้าทำปฏิกิริยา และปฏิกิริยานั้นสามารถเกิดขึ้นได้เอง (spontanoeus reaction)
ที่เหลือที่ทำงานได้มากกว่าตัวเข้าทำปฏิกิริยา ปฏิกิริยานั้นจึงมีแนวโน้มที่จะไม่เกิดขึ้นเอง
(non-spontaneous reaction) จึงต้องมีการดูดพลังงานเข้ามาในระบบเพื่อให้
การเปลี่ยนแปลงสามารถเกิดขึ้นได้เอง
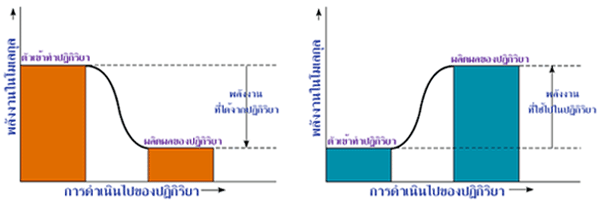
ภาพที่ 6.1 ปฏิกิริยาคายพลังงานและปฏิกิริยาดูดพลังงาน