์

ทบของสายเปปไทด์จะทำให้มี บริเวณเร่ง (active site) ซึ่งมีลักษณะเป็นร่องบนผิวของ
โมเลกุล ซึ่งสามารถจับกับตัวเข้าทำปฏิกิริยาหรือซับสเตรตเกิดเป็น โมเลกุลเชิงซ้อนซึ่ง
มีเอนไซม์จับกับตัวเข้าทำปฏิกิริยา (enzyme-substrate complex) ตัวเข้าทำปฏิกิริยา
นั้นจะถูกยึดไว้โดยแขนงข้างของกรดอะมิโน (amino acid side chain) ที่อยู่ในร่อง
และถูกชักนำให้เข้าสู่สภาพเปลี่ยนได้ง่ายและรวดเร็วขึ้น ดังนั้นพลังงานอิสระของการ
กระตุ้นจึงถูกลดลง จากนั้นตัวเข้าทำปฏิกิริยาที่อยู่ในสภาพเปลี่ยนจะมีการเปลี่ยนแปลง
โครงสร้างกลายเป็น โมเลกุลเชิงซ้อนซึ่งมีเอนไซม์จับกับผลิตผลของปฏิกิริยา
(enzyme-product complex) ซึ่งจะแตกตัวให้ผลิตผลของปฏิกิริยาหลุดออกไป
จากเอนไซม์
นั้นเกิดขึ้นจากการที่ตัวเข้าทำปฏิกิริยาสามารถเข้าจับบริเวณเร่งของเอนไซม์ได้อย่างพอดี
และการจับกันระหว่างตัวเข้าทำปฏิกิริยากับเอนไซม์ไม่ได้อาศัยการเข้ากันทางรูปร่างอย่างเดียว
แต่ต้องเป็นการเข้ากันทางด้านคุณสมบัติทางเคมีด้วย เพื่อให้มีแรงดึงดูดชนิดอ่อน เช่น
พันธะไฮโดรเจน (hydrogen bond) แรงไฮโดรโฟบิค (hydrophobic interaction) และ
แรงแวนเดอร์ วาลส์ (vander waals interaction) เกิดขึ้นระหว่างกรดอะมิโนในบริเวณเร่งของ
เอนไซม์กับตัวเข้าทำปฏิกิริยาในจำนวนมากเพียงพอที่จะสามารถยึดตัวเข้าทำปฏิกิริยาไว้ได้
แน่น นอกจากนี้การจับกันอย่างพอเหมาะระหว่างเอนไซม์และตัวเข้าทำปฏิกิริยาอาจต้องอาศัย
การเปลี่ยนแปลงโครงรูปของบริเวณเร่งของเอนไซม์หรือของตัวเข้าทำปฏิกิริยาเล็กน้อยด้วย
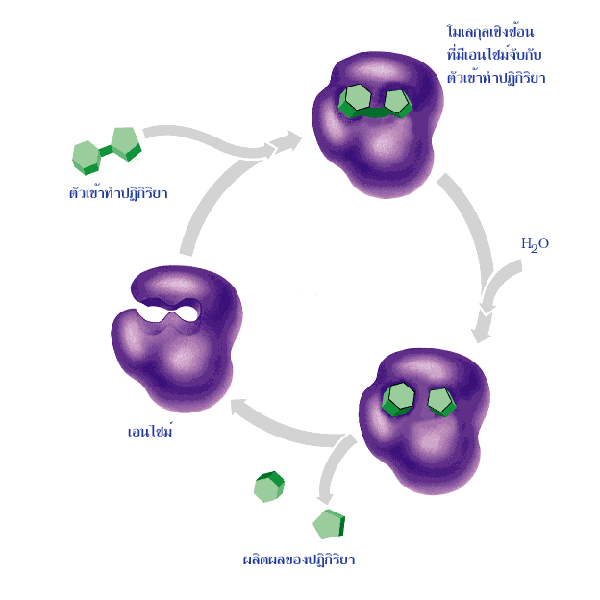
ภาพที่ 6.5 การทำงานของเอนไซม์