
![]() ประโยชน์จากการเรียนเรื่องโครงสร้างอะตอม
ประโยชน์จากการเรียนเรื่องโครงสร้างอะตอม
1. ทราบสมบัติทางเคมีและสมบัติการเปล่งแสงของธาตุ
ตัวอย่างที่ 1 ธาตุโซเดียม(Na)
![]() สมบัติทางเคมี
ธาตุโซเดียมสามารถให้อิเล็กตรอนกับธาตุอื่นได้ เช่น ธาตุคลอรีน(Cl)
สมบัติทางเคมี
ธาตุโซเดียมสามารถให้อิเล็กตรอนกับธาตุอื่นได้ เช่น ธาตุคลอรีน(Cl)
โครงสร้างอะตอมของธาตุโซเดียม
จะเห็นว่าธาตุโซเดียมมีอิเล็กตรอนวงนอกสุด 1 ตัว จึงพร้อมที่จะให้อิเล็กตรอนตัวนี้หลุดออกไป เพื่อให้อิเล็กตรอนวงนอกสุดครบ 8 ตัวเหมือนแก๊สเฉื่อย
จากภาพจะเห็นว่า ธาตุโซเดียมให้อิเล็กตรอน 1 ตัวกับธาตุคลอรีน ทำให้โซเดียมไอออนและคลอรีนไอออนมีอิเล็กตรอนวงนอกสุดครบ 8 ตัว เกิดเป็นสารประกอบ NaCl นั่นก็คือเกลือที่เรารับประทานนั่นเอง เราจะเห็นว่า "วิชาเคมีเป็นเรื่องใกล้ตัวเรามาก"
จากค่าอิเล็กโตรเนกาติวิตี(electronegativity)ของ Na = 0.9, Cl = 3.0 จะเห็นว่า Cl มีค่าอิเล็กโตรเนกาติวิตีสูงกว่า Na มาก ดังนั้น Cl จึงสามารถดึงดูดอิเล็กตรอนเข้าหาตัวเองได้
ธาตุโซเดียมกับธาตุคลอรีนเกิดพันธะเคมีแบบพันธะไออนิก(ionic bonding) ซึ่งเราจะได้ศึกษาต่อไปในเรื่องพันธะเคมี เราสามารถเขียนเป็นสมการเคมีได้ดังนี้
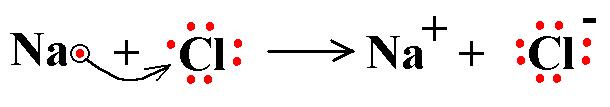
เราสามารถเขียนการจัดเรียงอิเล็กตรอนของธาตุโซเดียมและธาตุคลอรีนได้
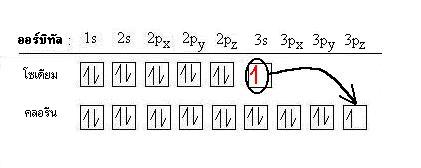
ธาตุคลอรีนดึง 1 อิเล็กตรอนใน 3s ออร์บิทัลของธาตุโซเดียมมา ทำให้ธาตุโซเดียมมีประจุบวก(เสียอิเล็กตรอน) ส่วนธาตุคลอรีนมีประจุลบ(รับอิเล็กตรอน)
![]() สมบัติการเปล่งแสงและการดูดกลืนแสงของธาตุโซเดียม
สมบัติการเปล่งแสงและการดูดกลืนแสงของธาตุโซเดียม
เมื่อทำตามการทดลองของโบร์(Bohr) โดยเปลี่ยนธาตุที่ใช้ในการบรรจุในหลอดปล่อยประจุจากธาตุไฮโดรเจนเป็นธาตุโซเดียม จะได้สเปกตรัมการเปล่งแสงดังรูป (a) และสเปกตรัมการดูดกลืนแสงดังรูป (b)
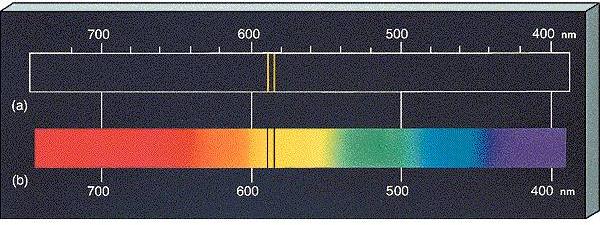
(a) สเปกตรัมการเปล่งแสง จะเห็นว่าธาตุโซเดียมเปล่งแสงสีเหลืองที่ความยาวคลื่น
589.00 และ 589.60 นาโนเมตรออกมา
(b) สเปกตรัมการดูดกลืนแสง
จะเห็นว่าธาตุโซเดียมดูดกลืนทุกแสงสียกเว้นแสงสีเหลืองที่ความยาวคลื่น 589.00
และ 589.60 นาโนเมตร
สเปกตรัมนี้เป็นลักษณะเฉพาะที่พบในธาตุโซเดียมเท่านั้น ดังนั้น ถ้าเรามีธาตุที่เราไม่ทราบว่าเป็นธาตุอะไร แล้วนำมาทำการทดลองเช่นเดียวกันนี้แล้วได้เส้นสเปกตรัมดังรูปด้านบน เราก็สรุปได้ว่าธาตุนั้นคือธาตุโซเดียม
ตัวอย่างที่ 2 ธาตุไฮโดรเจน(H)
![]() สมบัติทางเคมี
ธาตุไฮโดรเจนสามารถใช้อิเล็กตรอนร่วมกับตัวเองหรือธาตุอโลหะอื่นได้ เช่น
ไฮโดรเจน 2 อะตอม
สมบัติทางเคมี
ธาตุไฮโดรเจนสามารถใช้อิเล็กตรอนร่วมกับตัวเองหรือธาตุอโลหะอื่นได้ เช่น
ไฮโดรเจน 2 อะตอม
โครงสร้างอะตอมของธาตุไฮโดรเจน
จะเห็นว่าอะตอมของไฮโดรเจนมีอิเล็กตรอนวงนอกสุด 1ตัว ดังนั้น อะตอมของไฮโดรเจนจึงใช้ 1 อิเล็กตรอนร่วมกับอะตอมของไฮโดรเจนอีกอะตอมหนึ่ง จึงทำให้อะตอมของไฮโดรเจนทั้ง 2 มีอิเล็กตรอนวงนอกสุดครบ 2 ตัว
อะตอมของไฮโดรเจนกับอะตอมของไฮโดรเจน เกิดพันธะเคมีกันแบบพันธะโคเวเลนต์(covalent bonding) ซึ่งเราจะได้ศึกษาต่อไปในเรื่องพันธะเคมี เราสามารถเขียนเป็นสัญลักษณ์ของแก๊สไฮโดรเจนได้ดังนี้
แบบจุด แบบเส้น
เราสามารถเขียนการจัดเรียงอิเล็กตรอนของธาตุไฮโดรเจน 2 อะตอมได้
จะเห็นว่า การจัดเรียงอิเล็กตรอนของธาตุไฮโดรเจนคือ
1s1 จึงมี 1 อิเล็กตรอนเดี่ยวใน 1s ออร์บิทัล ที่ใช้ในการเกิดพันธะ(bonding
electron)
![]() สมบัติการเปล่งแสงและการดูดกลืนแสงของธาตุไฮโดรเจน
สมบัติการเปล่งแสงและการดูดกลืนแสงของธาตุไฮโดรเจน
เมื่อทำตามการทดลองของโบร์(Bohr) โดยบรรจุไฮโดรเจนเข้าไปในหลอดปล่อยประจุ จะได้สเปกตรัมการเปล่งแสงดังรูป (a) และสเปกตรัมการดูดกลืนแสงดังรูป (b)
จะได้สเปกตรัมการดูดกลืนแสงดังรูป (a)
และสเปกตรัมการเปล่งแสงดังรูป (b)
(a) สเปกตรัมการดูดกลืนแสง
จะเห็นว่าไฮโดรเจนดูดกลืนทุกแสงสียกเว้นที่ความยาวคลื่น 410, 434, 486 และ
656 นาโนเมตร
(b) สเปกตรัมการเปล่งแสง
จะเห็นว่าไฮโดรเจนเปล่งแสงที่ความยาวคลื่น 410, 434, 486 และ 656 นาโนเมตรออกมา
สเปกตรัมนี้เป็นลักษณะเฉพาะที่พบในธาตุไฮโดรเจนเท่านั้น ดังนั้น ถ้าเรามีธาตุที่เราไม่ทราบว่าเป็นธาตุอะไร แล้วนำมาทำการทดลองเช่นเดียวกันนี้แล้วได้เส้นสเปกตรัมดังรูปด้านบน เราก็สรุปได้ว่าธาตุนั้นคือธาตุไฮโดรเจน
2. เราสามารถศึกษาแกแล็กซี่(galaxy), ดวงดาวและดาวเคราะห์ต่าง ๆ โดยพิจารณาจากการศึกษาสเปกตรัมที่ได้จากดวงดาว

รูปแสดงเนบิวลา(nebula) ซึ่งเป็นกลุ่มหมอกของดวงดาวที่อยู่ในอวกาศ

จากการวิเคราะห์จนได้สเปกตรัม ซึ่งสเปกตรัมที่ได้สามารถบอกองค์ประกอบทางเคมีของเนบิวลา(nebula) นี้ว่าประกอบด้วยธาตุฮีเลียม(He), ออกซิเจน(O) และนีออน(Ne)