| 
 อนุภาคในอะตอม
อนุภาคในอะตอม
อะตอมประกอบด้วยอนุภาคมูลฐานที่สำคัญ 3 อนุภาค
ได้แก่
1.อิเล็กตรอน(electron)
2.โปรตอน(proton)
3.นิวตรอน(neutron)
อนุภาคขนาดเล็กคือโปรตอน,
นิวตรอน และอิเล็กตรอน มีคุณสมบัติต่างกันดังตาราง
อนุภาค |
สัญลักษณ์ |
ประจุ(คูลอมบ์) |
น้ำหนัก(กิโลกรัม) |
โปรตอน |
p |
+1.60x10-19 |
1.67x10-27 |
นิวตรอน |
n |
ไม่มีประจุ |
1.67x10-27 |
อิเล็กตรอน |
e- |
-1.60x10-19 |
9.11x10-31 |
จากตาราง
 อะตอมที่เป็นกลางทางไฟฟ้าจะมีประจุบวกเท่ากับประจุลบ แสดงว่าในอะตอมมีจำนวนโปรตอนเท่ากับจำนวนอิเล็กตรอนซึ่งในอะตอมจะมีโปรตอนจำนวนเท่ากับ "เลขอะตอม"
อะตอมที่เป็นกลางทางไฟฟ้าจะมีประจุบวกเท่ากับประจุลบ แสดงว่าในอะตอมมีจำนวนโปรตอนเท่ากับจำนวนอิเล็กตรอนซึ่งในอะตอมจะมีโปรตอนจำนวนเท่ากับ "เลขอะตอม"
จำนวนโปรตอน
= จำนวนอิเล็กตรอน
 โปรตอนกับนิวตรอนเป็นอนุภาคที่มีน้ำหนักมากเมื่อเทียบกับอิเล็กตรอน
ดังนั้นมวลของอะตอมก็คือจำนวนโปรตอนรวมกับจำนวนนิวตรอน นั่นคือ "เลขมวล"
โปรตอนกับนิวตรอนเป็นอนุภาคที่มีน้ำหนักมากเมื่อเทียบกับอิเล็กตรอน
ดังนั้นมวลของอะตอมก็คือจำนวนโปรตอนรวมกับจำนวนนิวตรอน นั่นคือ "เลขมวล"
เลขมวล
= จำนวนโปรตอน + จำนวนนิวตรอน
เราสามารถเขียนเป็นสัญลักษณ์เพื่อระบุเลขอะตอมและเลขมวลได้ดังนี้
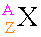
เมื่อ
A แทน เลขมวล
Z แทน เลขอะตอม
X แทน สัญลักษณ์ของธาตุ
เช่น
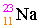
เลขอะตอม
= จำนวนโปรตอน
= จำนวนอิเล็กตรอน
11 =
จำนวนโปรตอน = จำนวนอิเล็กตรอน
เลขมวล
= จำนวนโปรตอน + จำนวนนิวตรอน
23
=
11
+
จำนวนนิวตรอน
จำนวนนิวตรอน = 23
- 11 = 12
นั่นคือ ธาตุโซเดียมมีจำนวนโปรตอน,
อิเล็กตรอนและนิวตรอนเท่ากับ 11, 11, 12 ตามลำดับ
ถ้าอยากทราบว่าธาตุใดมีจำนวนโปรตอน, นิวตรอนและอิเล็กตรอนเท่าใด
ให้คลิกที่ธาตุนั้นได้เลย
จะเห็นได้ว่า ธาตุแต่ละธาตุมีจำนวนโปรตอน, นิวตรอนและอิเล็กตรอนต่างกันไป
ทำให้แต่ละธาตุมีสมบัติทางเคมีต่างกัน
อนุภาคต่างๆ ทั้งโปรตอน นิวตรอน และอิเล็กตรอน มีขนาดเล็กมากๆ ซึ่งเล็กกว่าเส้นผ่านศูนย์กลางของเส้นผม
นักวิทยาศาสตร์สามารถค้นพบอนุภาคเหล่านี้ได้อย่างไร จึงเป็นเรื่องที่น่าสนใจมาก
|
