![]()
![]()
ตัวเร่งปฏิกิริยา (catalyst) ในบางกรณี การเพิ่มอัตราการเกิดปฏิกิริยาโดยเพิ่มอุณหภูมิหรือความเข้มข้นของสารตั้งต้นอาจไม่เหมาะในเชิงปฏิบัติ วิธีที่เหมาะที่สุดคือ การเติมตัวเร่งปฏิกิริยาลงไป เช่น การเตรียมแก๊สออกซิเจน (O2) จากการเผาโพแทสเซียมคลอเรต (KClO3) จะได ้O2 ค่อนข้างช้า ถ้าเราเติมแมงกานีสไดออกไซด์ (MnO2) ลงไปด้วย MnO2 จะช่วยเร่งให้เกิด O2 ได้เร็วขึ้น แต่สุดท้ายแล้วมันเองจะไม่มีการเปลี่ยนแปลง มีเพียง KClO3 เท่านั้นที่เปลี่ยนเป็นผลิตภัณฑ์ คือ KCl และ O2 เราจึงให้ความหมายของตัวเร่งปฏิกิริยาว่าเป็นสารที่ทำให้อัตราการเกิดปฏิกิริยาสูงขึ้นโดยที่สารตัวเร่งปฏิกิริยาสามารถกลับคืนสู่รูปเดิมได้ ตัวเร่งปฏิกิริยาอาจจะเข้าทำปฏิกิริยาแล้วเกิดเป็นสารมัธยันตร์ (intermediate) แต่ก็จะกลับคืนรูปเดิมได้ในปฏิกิริยาย่อยขั้นต่อๆ ไป
การอธิบายว่าตัวเร่งปฏิกิริยาเป็นปัจจัยที่มีผลต่ออัตราการเกิดปฏิกิริยา ก็ยังคงต้องใช้ทฤษฎีการชน และกราฟการกระจายอนุภาคของแมกซ์เวล-โบลซ์มันน์เช่นเดียวกับการเปลี่ยนแปลงอุณหภูมิ ดังนี้
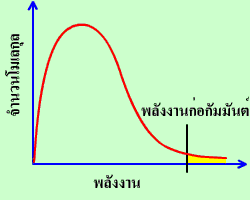
การแจกแจงพลังงานของอนุภาคเมื่อไม่มีตัวเร่งปฏิกิริยา |
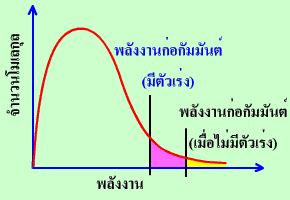
การแจกแจงพลังงานของอนุภาคเมื่อมีตัวเร่งปฏิกิริยา |
รูปแรกเราคงคุ้นเคยกันดีแล้ว ส่วนรูปที่สองเป็นกราฟการแจกแจงพลังงานของอนุภาคเมื่อมีตัวเร่งปฏิกิริยา จะสังเกตได้ว่ามีบางอย่างเปลี่ยนไป สิ่งที่เปลี่ยนไปก็คือ ตำแหน่งของพลังงานก่อกัมมันต์เลื่อนมาทางซ้ายมากขึ้น จำนวนอนุภาคทางขวาของพลังงานก่อกัมมันต์มีมากขึ้น จึงเพิ่มโอกาสให้อนุภาคเกิดปฏิกิริยามากขึ้น ดังนั้นการใช้ตัวเร่งปฏิกิริยาจึงทำให้อัตราการเกิดปฏิกิริยาเพิ่มมากขึ้นนั่นเอง
โปรดระวังว่า ตัวเร่งปฏิกิริยาไม่ได้เป็นตัวลดหรือทำให้พลังงานก่อกัมมันต์ลดลง แต่เป็นวิถี (pathway) หรือเส้นทางเลือกซึ่งมีพลังงานก่อกัมมันต์ต่ำกว่าพลังงานก่อกัมมันต์เดิม ที่กล่าวเช่นนี้ได้ก็เพราะอนุภาคที่มีพลังงานสูง(อยู่แล้ว)ก็ยังสามารถชนกันแล้วเกิดปฏิกิริยาที่สภาวะเดิมที่ไม่มีตัวเร่งปฏิกิริยาได้
ถ้าพิจารณากราฟการเปลี่ยนแปลงพลังงานเมื่อปฏิกิริยาดำเนินไป จะเป็นดังตัวอย่างต่อไปนี้
สมมติว่าปฏิกิริยามีค่าคงที่อัตราเป็น k และมีพลังงานก่อกัมมันต์เป็น Ea ดังสมการ
![]()
ถ้าใส่ตัวเร่งปฏิกิริยาลงไปด้วย
จะได้ค่าคงที่อัตราเป็น kc ซึ่งเรียกว่า ค่าคงที่อัตราเมื่อถูกเร่ง
(catalytic rate constant)
![]()
อัตราการเกิดปฏิกิริยาที่ถูกเร่งจะสูงกว่าอัตราการเกิดปฏิกิริยาที่ไม่มีตัวเร่ง
เพราะตัวเร่งปฏิกิริยาจะช่วยเพิ่มเส้นทางที่มีพลังงานก่อกัมมันต์ของปฏิกิริยาลดลง
ทำให้อัตราการเกิดปฏิกิริยาสูงขึ้น แต่พลังงานรวมของสารตั้งต้นและสารผลิตภัณฑ์จะไม่เปลี่ยนแปลง
ดังแสดงในกราฟ
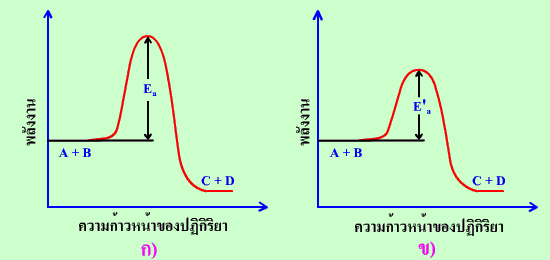
กราฟแสดงการเปรียบเทียบพลังงานก่อกัมมันต์ของปฏิกิริยา
ก) เมื่อไม่มีตัวเร่งปฏิกิริยา ข) เมื่อมีตัวเร่งปฏิกิริยา
จากกราฟ เราจะเห็นได้ว่า พลังงานก่อกัมมันต์ Ea ลดลงเป็น E'a และพลังงานก่อกัมมันต์ลดลงทั้งปฏิกิริยาที่เกิดไปข้างหน้าและย้อนกลับ ดังนั้นตัวเร่งปฏิกิริยาจึงเพิ่มอัตราการเกิดปฏิกิริยาทั้งปฏิกิริยาที่เกิดไปข้างหน้าและปฏิกิริยาที่เกิดย้อนกลับ
การดำเนินไปของปฏิกิริยา |
การเปลี่ยนแปลงระหว่างสารตั้งต้นกับสารผลิตภัณฑ์ เมื่อเวลาดำเนินไป ซึ่งอาจเกิดขึ้นหลายขั้นตอนและอาจมีสารมัธยันตร์ (intermediate) เกิดขึ้นระหว่างปฏิกิริยาก็ได้ |
หมายเหตุ : ศึกษารายละเอียดเพิ่มเติมในเรื่อง การเร่งปฏิกิริยา