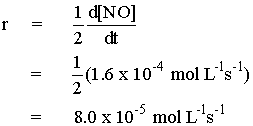![]()
อัตราการเกิดปฏิกิริยา (reaction rate, r) หมายถึง การเปลี่ยนแปลงความเข้มข้นของสารตั้งต้นหรือสารผลิตภัณฑ์เมื่อเวลาเปลี่ยนไป
![]()
ความสัมพันธ์ระหว่างความเข้มข้นของสารตั้งต้นและสารผลิตภัณฑ์กับเวลา
ในขณะที่เกิดปฏิกิริยาโมเลกุลของสารตั้งต้นก็จะเปลี่ยนเป็นสารผลิตภัณฑ์ ทำให้ความเข้มข้นของสารตั้งต้นลดลง ส่วนความเข้มข้นของสารผลิตภัณฑ์ก็จะเพิ่มขึ้นเรื่อยๆ เราจึงสามารถติดตามการดำเนินไปของปฏิกิริยาได้จาก
![]() การวัดความเข้มข้นที่ลดลงของสารตั้งต้น
การวัดความเข้มข้นที่ลดลงของสารตั้งต้น
![]() การวัดความเข้มข้นที่เพิ่มขึ้นของสารผลิตภัณฑ์
การวัดความเข้มข้นที่เพิ่มขึ้นของสารผลิตภัณฑ์
หมายเหตุ
: |
ในการวัดอัตราการเกิดปฏิกิริยามีสิ่งที่ต้องคำนึงถึง คือ |
|
| 1. | ต้องทำการผสมสาร (เขย่า) ด้วยความสม่ำเสมอ | |
| 2. | เมื่อผสมสารเสร็จต้องรีบทำการวัดทันที | |
| 3. | การผสมสารด้วยมือ จะหาอัตราการเกิดปฏิกิริยาเริ่มต้น (initial rate) จริงๆ ได้ ยากมากเพราะเมื่อผสมสารด้วยมือเสร็จแล้วทำการวัด ก็หมายความว่า เวลาได้ผ่านไปแล้วอย่างน้อย 3 วินาที | |
| 4. | ต้องทำการทดลองที่ความเข้มข้นต่ำๆ ตั้งแต่ระดับมิลลิโมลาร์ (mM) ลงมา | |
![]()
พิจารณาปฏิกิริยา
![]()
ถ้าแทนความเข้มข้นของสารในปฏิกิริยา คือ [A], [B] และ [C] เราจะสามารถหาอัตราการเกิดปฏิกิริยาได้จาก
| |
|
| (อัตราการลดลงใส่เครื่องหมายลบ) |
ตัวอย่างที่ 1 การสลายตัวของ H2O2 ได้เป็น O2 และ H2O
| อัตราการเกิดปฏิกิริยา คือ | 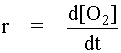 |
![]()
พิจารณาปฏิกิริยา
![]()
จะได้ว่า
อัตราการเกิดสารผลิตภัณฑ์ C = 3 x (อัตราการลดลงของสารตั้งต้น A)
อัตราการเกิดปฏิกิริยา คือ
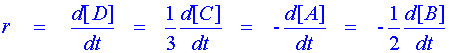
ตัวอย่างที่ 2 จากปฏิกิริยาการสลายตัวของ NOBr พบว่า อัตราการเกิด NO มีค่าเท่ากับ 1.6 x 10-4 mol L-1 s-1 จงคำนวณอัตราการเกิดปฏิกิริยา และอัตราการลดลงของ NOBr ?
![]()
วิธีคิด
จากสมการเคมี จะได้ว่า
|
| ดังนั้น อัตราการเกิดปฏิกิริยา หาได้จาก |
อัตราการเกิดปฏิกิริยา มีค่าเท่ากับ 8.0 x 10-5 mol L-1 s-1 |
| และเนื่องจาก อัตราการลดลงของ NOBr เป็น 2 เท่าของอัตราการเกิดปฏิกิริยา จึงได้ว่า |
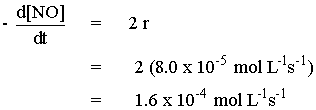 |
| ดังนั้น อัตราการลดลงของ NOBr มีค่าเท่ากับ 1.6 x 10-4 mol L-1 s-1 |
![]()
| เมื่อมีการเปลี่ยนแปลงสภาวะต่าง ๆ ของปฏิกิริยา เช่น อุณหภูมิ หรือความเข้มข้น นักเรียนคิดว่า อัตราการเกิดปฏิกิริยาจะมีการเปลี่ยนแปลงไปอย่างไร? |
จากการทดลองพบว่า ปัจจัยที่เกี่ยวข้องกับอัตราการเกิดปฏิกิริยามี 6 ปัจจัย ดังนี้
| 1. | ธรรมชาติของสารทำปฏิกิริยา | |
| 2. | ความเข้มข้นของสารทำปฏิกิริยา | |
| 3. | ความดันของสารทำปฏิกิริยา | |
| 4. | อุณหภูมิ | |
| 5. | ตัวเร่งปฏิกิริยา | |
| 6. | พื้นที่ผิว |