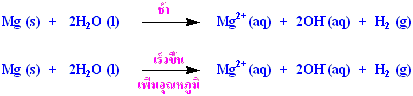![]()
![]()
การเพิ่มอุณหภูมิเป็นสภาวะที่สามารถเพิ่มการชนได้ เพราะเมื่อเพิ่มอุณหภูมิหรือให้ความร้อนแก่สารในปฏิกิริยา อนุภาคจะมีพลังงานจลน์เพิ่มขึ้น จะเคลื่อนที่ได้เร็วขึ้น ชนกันมากขึ้น โอกาสที่จะชนกันแล้วเกิดปฏิกิริยาก็จะมีมากขึ้น เมื่อเกิดปฏิกิริยามากขึ้นอัตราการเกิดปฏิกิริยาก็เพิ่มขึ้นนั่นเอง
ปฏิกิริยาเคมีโดยทั่วไปเมื่อมีการเพิ่มอุณหภูมิจะส่งผลให้อัตราการเกิดปฏิกิริยาเพิ่มขึ้น แต่ในบางปฏิกิริยาอุณหภูมิก็ไม่มีส่วนที่จะทำให้อัตราการเกิดปฏิกิริยาเพิ่มขึ้น เช่น ปฏิกิริยาระหว่างไฮโดรเจนไอออนและไฮดรอกไซด์ไอออนในปฏิกิริยาสะเทิน(neutralization reaction) เป็นต้น
การอธิบายว่าอุณหภูมิเป็นปัจจัยที่มีผลต่ออัตราการเกิดปฏิกิริยา ต้องใช้ทฤษฎีการชน และกราฟการแจกแจงพลังงานของอนุภาคของแมกซ์เวล-โบลซ์มันน์ ดังนี้
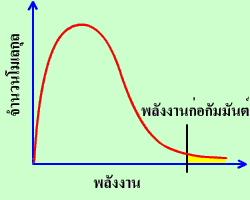
การแจกแจงพลังงานของอนุภาคของแมกซ์เวล-โบลซ์มันน์
อนุภาคในพื้นที่ใต้กราฟทางด้านขวาของพลังงานก่อกัมมันต์เท่านั้นที่มีโอกาสชนกันแล้วเกิดปฏิกิริยาเพราะเป็นอนุภาคที่มีพลังงานสูง ส่วนอนุภาคในพื้นที่ใต้กราฟทางด้านซ้ายของพลังงานก่อกัมมันต์ซึ่งเป็นอนุภาคส่วนใหญ่จะมีโอกาสชนกันได้แต่ไม่มีพลังงานมากพอที่จะเกิดปฏิกิริยา ถ้าลองสร้างกราฟการแจกแจงพลังงานของอนุภาคเมื่อให้ความร้อนแก่สารในปฏิกิริยาเปรียบเทียบกับกราฟเดิม จะได้ดังรูป

การแจกแจงพลังงานของอนุภาคเมื่อให้ความร้อนแก่สารในปฏิกิริยา
พบว่ารูปร่างของกราฟเปลี่ยนแปลงไป โดยจะโย้ไปทางขวามากขึ้น โปรดสังเกตว่าเส้นกราฟไม่ได้มีการเปลี่ยนแปลงมากนัก อนุภาคซึ่งมีโอกาสชนกันได้แต่ไม่มีพลังงานมากพอที่จะเกิดปฏิกิริยาก็ยังเป็นอนุภาคส่วนใหญ่ อนุภาคในพื้นที่ใต้กราฟทางด้านขวาของพลังงานก่อกัมมันต์ที่มีโอกาสชนกันแล้วเกิดปฏิกิริยาก็ยังมีเป็นส่วนน้อย แต่ก็มีจำนวนมากขึ้นเพียงพอที่จะทำให้ปฏิกิริยาเกิดมากขึ้น จนทำให้อัตราการเกิดปฏิกิริยาเพิ่มขึ้นด้วย ดังจะเห็นได้จากปฏิกิริยาที่เกิดขึ้นได้ที่อุณหภูมิห้อง มักจะมีอัตราการเกิดปฏิกิริยาเพิ่มขึ้นเป็นสองเท่าเมื่อมีอุณหภูมิเพิ่มขึ้น 9 - 11 oC โดยเฉพาะอย่างยิ่งปฏิกิริยาคายความร้อน การเปลี่ยนแปลงอุณหภูมิเพียงเล็กน้อยจะส่งผลต่ออัตราการเกิดปฏิกิริยาอย่างมาก เช่น ปฏิกิริยาระหว่างน้ำ (ที่มีสารละลายฟีนอล์ฟทาลีน) กับโลหะแมกนีเซียมจะเกิดช้ามากที่อุณหภูมิห้อง แต่จะทำปฏิกิริยากับน้ำร้อนได้เร็วขึ้น
ปฏิกิริยาของแผ่นโลหะแมกนีเซียม
(Mg) กับน้ำร้อน |
หมายเหตุ : ศึกษารายละเอียดเพิ่มเติมในเรื่อง พลังงานก่อกัมมันต์และผลของอุณหภูมิต่อค่าคงที่อัตรา