| |
4. การละลายได้ (solubility)
จากรูป
a |
เมื่อใส่ตัวถูกละลายซึ่งเป็นของแข็งชนิดหนึ่งลงในตัวทำละลายที่เป็นของเหลว จะเห็นว่า จะเริ่มมีการละลายเกิดขึ้น |
ในรูป
b |
จะเห็นได้ว่าตัวถูกละลายจะเริ่มละลาย และจะละลายมากขึ้น |
ในรูป
c |
ตัวถูกละลายจะละลาย และจะละลายมากขึ้นเรื่อยๆ |
ใน
รูป d |
เมื่อถึงจุดๆ หนึ่งปรากฏว่าของแข็งไม่สามารถละลายได้อีกต่อไป หรือที่เรารู้จักกันดี คือ สารละลายอิ่มตัว |
เพราะฉะนั้น ในสารละลายของเหลว ที่อุณหภูมิหนึ่งๆ ปริมาณของตัวถูกละลายที่สามารถละลายในตัวทำละลายได้ จะมีปริมาณจำกัด โดยเรียกสารละลายที่ตัวถูกละลายไม่สามารถละลายเพิ่มได้อีกว่า สารละลายอิ่มตัว (saturated solution) โดยปริมาณของตัวถูกละลายที่ละลายได้ในสารละลายอิ่มตัว ณ ที่อุณหภูมิหนึ่ง ๆ เรียกว่า การละลายได้ ( solubility) เช่น เกลือแกง (NaCl) ละลายในน้ำ 100 ลูกบาศก์เซนติเมตร ที่อุณหภูมิ 100 oC สามารถละลายได้ 39.1 กรัม แต่ถ้าใส่เกลือไปมากกว่านี้ ส่วนที่เหลือก็จะไม่ละลาย
ในสารละลายที่อิ่มตัว ตัวถูกละลายจะมีอัตราการละลายจะเท่ากับอัตราการกลับคืนมาเป็นของแข็ง เพราะฉะนั้นความเข้มข้นของสารละลายของสารละลายที่อิ่มตัวจะคงที่ ตัวถูกละลายที่ไม่สามารถละลายจะไม่ทำให้ความเข้มข้นของสารละลายเปลี่ยนแปลงแต่อย่างใด ถ้าตัวทำละลายเป็นน้ำ โดยทั่วไปนิยมบอกหน่วยหรือปริมาณของการละลายได้ของตัวถูกละลายเป็นกรัม (g) ในตัวทำละลายน้ำ 100 กรัม
นอกจากนั้น การละลายได้ของตัวถูกละลายจะขึ้นอยู่กับปัจจัยหลายประการ เช่น ธรรมชาติของตัวทำละลายและตัวถูกละลาย อุณหภูมิ และความดัน เป็นต้น
4.1 อิทธิพลของอุณหภูมิที่มีต่อการละลายได้
ถ้าการละลายของสารเป็นการ ดูดความร้อน ดังปฏิกิริยา
| ตัวถูกละลาย
(s) + ตัวทำละลาย (l) + ความร้อน |
สารละลาย (l) |
เมื่ออุณหภูมิเพิ่มขึ้น โดยทั่วไป การละลายได้ของสารจะเพิ่มขึ้น
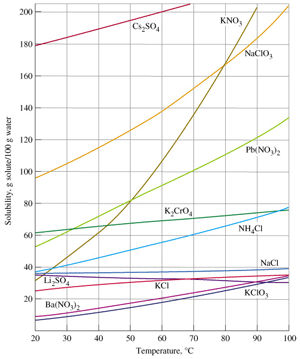 |
จากกราฟ จะเห็นได้ว่า เมื่ออุณหภูมิสูงขึ้น แนวโน้มของการละลายของสารในน้ำ 100 กรัม จะเพิ่มสูงขึ้น เราสามารถบอกความสามารถในการละลายได้จากความชันของกราฟ โดย สารที่มีความชันมาก เมื่อเพิ่มอุณหภูมิ แนวโน้มการดูดความร้อนสูง ดังนั้น การละลายจะสูง เช่น KNO3, NaClO3, Cs2SO4 เป็นต้น ในทางกลับกัน สารที่มีความชันน้อย เมื่อเพิ่มอุณหภูมิ แนวโน้มการดูดความร้อนจะน้อย ดังนั้น การละลายจะน้อย เช่น K2CrO4, KClO3 เป็นต้น |
ในทางตรงกันข้าม ถ้าการละลายของตัวถูกละลายในตัวทำละลายเป็นการ คายความร้อน การให้ความร้อนแก่ระบบ จะยิ่งทำให้ตัวถูกละลายละลายได้น้อยลง
4.2 อิทธิพลของความดันที่มีต่อการละลายได้
การเพิ่มความดันมีผลอย่างมากต่อการละลายของแก๊สในของเหลว มากกว่าการละลายของของแข็งในของเหลว
|
ตัวถูกละลาย (g) + ตัวทำละลาย (l) + ความดัน |
สารละลาย (l) |
พิจารณาอิทธิพลของความดันที่ให้ต่อแก๊สในสารละลาย ต่อไปนี้
เมื่อกำหนดให้
|
เมื่อเพิ่มความดันต่อแก๊ส พบว่า แก๊สสามารถละลายในของเหลวได้มากขึ้น จำนวนโมเลกุลของแก๊สที่อยู่เหนือของเหลวจะลดลง และความเข้มข้นของแก๊สในสารละลายจะเพิ่มขี้น
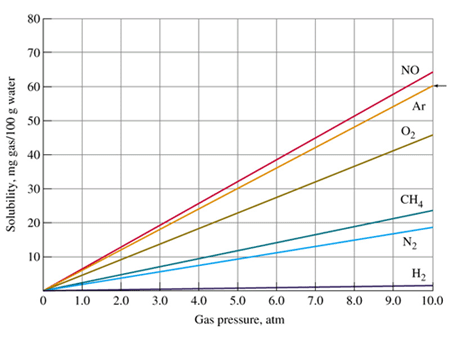
จากกราฟ จะเห็นได้ว่า แนวโน้มการละลายได้ของแก๊สในน้ำ
100 กรัม เพิ่มสูงขึ้น เมื่อเพิ่มความดันให้แก๊ส |