| |
3. กระบวนการเกิดสารละลาย
ในกระบวนการเกิดสารละลายได้นั้น อนุภาคของตัวถูกละลายจะต้องสามารถกระจายตัวเข้าไปแทรกตัวอยู่ระหว่างอนุภาคของตัวทำละลายได้อย่างทั่วถึง
เมื่อกำหนดให้
|
การที่อนุภาคของตัวถูกละลายจะเข้าไปแทรกตัวอยู่ระหว่างอนุภาคของตัวทำละลายได้หรือไม่ จะขึ้นอยู่กับแรงดึงดูดระหว่างโมเลกุลของตัวทำละลายกับตัวทำละลาย แรงดึงดูดโมเลกุลระหว่างตัวทำละลายกับตัวถูกละลาย และแรงดึงดูดระหว่างโมเลกุลตัวถูกละลายกับตัวถูกละลาย
ปกติแล้ว การที่ตัวถูกละลายจะละลายในตัวทำละลายหนึ่ง ๆ ได้นั้น สารทั้งสองชนิดจะต้องมีสมบัติเหมือนกัน ตามกฎ like dissolves like ก็คือ ตัวถูกละลายที่มีขั้วจะละลายในตัวทำละลายที่มีขั้ว เพราะแรงดึงดูดระหว่างโมเลกุลมีขั้วเป็นแรงไดโพล-ไดโพล (dipole-dipole) แต่จะไม่ละลายในตัวทำละลายที่ไม่มีขั้ว เช่น เอทานอล (CH3CH2OH) ละลายในน้ำ (H2O) แต่ไม่ละลายในเฮกเซน (C6H14) ในทางตรงข้าม ตัวถูกละลายที่ไม่มีขั้วจะละลายในตัวทำละลายที่ไม่มีขั้ว เพราะแรงดึงดูดระหว่างโมเลกุลไม่มีขั้วเป็นแรงแวนเดอร์วาลล์ (Van der Waals force) เหมือนกัน แต่จะไม่ละลายในตัวทำละลายที่มีขั้ว เช่น คาร์บอนเตตระคลอไรด์ (CCl4) ละลายในเบนซีน (C6H6) ไม่ละลายในน้ำ แต่ถ้าในกรณีที่สารหนึ่งมีขั้วน้อยกว่าอีกสารตัวหนึ่ง ความสามารถในการละลายก็ลดลง หรืออาจจะกล่าวอีกนัยคือละลายได้เพียงบางส่วนเท่านั้น
จากที่กล่าวมาจะเป็นการละลายของของเหลวในของเหลวด้วยกัน ในกรณีที่เป็นการละลายของของแข็งในของเหลว ก็สามารถอธิบายโดยใช้แรงดึงดูดระหว่างโมเลกุลเช่นเดียวกัน ถ้าตัวถูกละลายเป็นสารประกอบไอออนิก ซึ่งมีแรงดึงดูดระหว่างไอออนสูงมาก ก็จะละลายในตัวทำละลายที่มีขั้วแรงได้ดีกว่าตัวทำละลายที่มีขั้วน้อยกว่า เพราะฉะนั้น สารประกอบไอออนิกจึงละลายได้ดีในตัวทำละลายที่มีขั้วแรงมากๆ เช่น เกลือ (โซเดียมคลอไรด์ : NaCl) ละลายได้ดีในน้ำ มากกว่าในตัวทำละลายที่เป็นสารประกอบพวกไฮโดรคาร์บอน (hydrocarbon compounds)
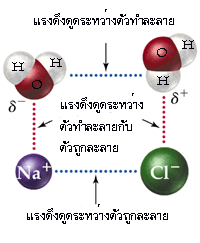
จากรูปข้างต้น เมื่อโมเลกุลของ NaCl อยู่ในน้ำ การที่ NaCl สามารถละลายในน้ำได้ แสดงว่า แรงดึงดูดระหว่างขั้วของน้ำกับไอออนบวก (Na+) และไอออนลบ (Cl-) จะต้องสูงกว่าแรงดึงดูดระหว่างไอออนในโครงผลึกของ NaCl จึงจะทำให้ไอออนบวก (Na+) และไอออนลบ (Cl-) หลุดออกมาจากโครงผลึก จากนั้นโมเลกุลของน้ำก็จะเข้าไปล้อมรอบไอออนทั้งสองชนิด พบว่า ไออนของ Na+ 1ไอออน จะถูกห้อมล้อมด้วยโมเลกุลของน้ำ 4 โมเลกุล หรือบางครั้งโมเลกุลของน้ำอาจจะล้อมรอบไอออน Na+ ถึง 6โมเลกุล และเมื่อพิจารณา Cl- 1ไอออน พบว่า จะถูกห้อมล้อมด้วยโมเลกุลของน้ำเพียง 4 โมเลกุล และเรียกไอออนที่ถูกห้อมล้อมด้วยโมเลกุลของน้ำว่า "hydrated ion"