จากที่กล่าวมาแล้วว่าเอนไซม์ส่วนใหญ่เป็นโปรตีน ความสามารถในการทำงานของเอนไซม์ขึ้นอยู่กับโครงสร้างสามมิติ อันเกิดจากการม้วนและทบของสายพอลิเพปไทด์นั้น ทำให้โมเลกุลของเอนไซม์เกิดเป็นร่องสามมิติอยู่บนผิวโมเลกุล ที่เรียกว่า บริเวณเร่ง (active site) ซึ่งเป็นบริเวณที่สามารถรับซับสเตรต (substrate) ที่มีโครงรูปสามมิติเช่นเดียวกัน ให้เข้ามาจับได้ โดยที่แขนงข้าง (side chain หรือ R group) ของกรดอะมิโนที่อยู่ในร่อง จะทำการยึดส่วนต่างๆ ของซับสเตรตเอาไว้อย่างพอเหมาะ ซึ่งจะทำให้ซับสเตรตถูกชักนำให้เกิดการเปลี่ยนแปลงทางรูปร่างและทางเคมี เพื่อเข้าสู่สภาพเปลี่ยนได้ง่ายและรวดเร็วยิ่งขึ้น ดังนั้นพลังงานอิสระของการกระตุ้นจึงถูกลดลงโดยปัจจัยนี้ด้วย
ความจำเพาะของเอนไซม์มีหลายระดับ
ทั้งต่อซับสเตรต ผลิตภัณฑ์ และปฏิกิริยา กล่าวคือ เอนไซม์บางชนิดจะจำเพาะต่อซับสเตรตทั้งโมเลกุล
สารอื่นที่มีโครงสร้างคล้ายกัน เอนไซม์ก็ไม่สามารถใช้เป็นซับสเตรตได้ เช่น
กลูโคสออกซิเดส จะเร่งปฏิกิริยาการเปลี่ยนน้ำตาลกลูโคสเฉพาะชนิด ดี-กลูโคสเท่านั้น
ขณะที่เอนไซม์บางชนิดจะจำเพาะต่อหมู่บางหมู่ของซับสเตรต จึงอาจมีสับสเตรตได้หลายตัว
เนื่องจากมีโครงสร้างคล้ายกัน เช่น เอนไซม์แอลกอฮอล์ดีไฮโดรจีเนส จะเร่งปฏิกิริยาออกซิเดชันของแอลกอฮอล์ชนิดต่างๆ
หรือเอนไซม์เฮกโซไคเนส จะเร่งปฏิกิริยาการย้ายหมู่ฟอสเฟตจาก ATP ไปให้น้ำตาลเฮกโซสต่างๆ
ในขณะที่เอนไซม์บางชนิดจะมีความจำเพาะสูงมาก เนื่องจากสามารถแยกโครงสร้างสเตอริโอของซับสเตรตได้และเลือกที่จะใช้ซับสเตรตที่เป็นไอโซเมอร์ใดไอโซเมอร์หนึ่งเท่านั้น
เช่น เอนไซม์ แอลอะมิโนแอซิด ออกซิเดส ( L-amino acid oxidase) จะใช้กรดอะมิโนไอโซเมอร์แอลเป็นซับสเตรตเท่านั้น
![]() ตัวอย่างของเอนไซม์ที่มีความจำเพาะสูงมาก
ตัวอย่างของเอนไซม์ที่มีความจำเพาะสูงมาก ![]()
กลูโคสออกซิเดส (glucose oxidase : EC 1.1.3.4) จะเร่งปฏิกิริยา
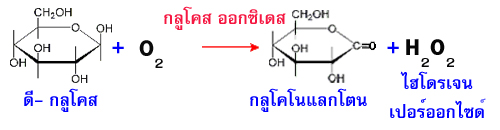
เอนไซม์นี้จะใช้ซับสเตรตคือ เบตา- ดี-กลูโคสเท่านั้น ไม่สามารถใช้น้ำตาลตัวอื่นๆ เช่น แอลฟา-ดี-กลูโคส หรือ เบตา-ดี-กาแลกโตสได้
![]() ตัวอย่างของเอนไซม์ที่มีความจำเพาะไม่สูงมากนัก
ตัวอย่างของเอนไซม์ที่มีความจำเพาะไม่สูงมากนัก ![]()
ไคโมทริปซิน (chymotrypsin : EC 3.4.21.1)
ไคโมทริปซินจะเร่งปฏิกิริยาการแตกสลายพันธะเพปไทด์ในโปรตีน โดยมีความจำเพาะตรงที่ซับสเตรตต้องมี หมู่ R เป็นกลุ่มไฮโดรโฟบิค (hydrophobic) เช่น ฟีนิลอะลานีน (phenylalanine) และ ทริปโตเฟน (tryptophan) เป็นต้น
ทริปซิน (trypsin : EC 3.4.21.4)
ทริปซินจะเร่งปฏิกิริยาการแตกสลายพันธะเพปไทด์ในโปรตีนเช่นกัน แต่ต้องการซับสเตรตต้องมี หมู่ R เป็นกลุ่มที่มีประจุบวก เช่น ไลซีน (lysine) อาร์จินีน (arginine) และ ฮีสติดีน เป็นต้น
![]() ตัวอย่างของเอนไซม์ที่มีความจำเพาะน้อย
ตัวอย่างของเอนไซม์ที่มีความจำเพาะน้อย ![]()
โปรเนส (pronase)
เป็นเอนไซม์ที่สามารถแตกสลายพันธะเพปไทด์ โดยไม่จำเพาะว่าหมู่ R ของซับสเตรตว่าเป็นอะไร
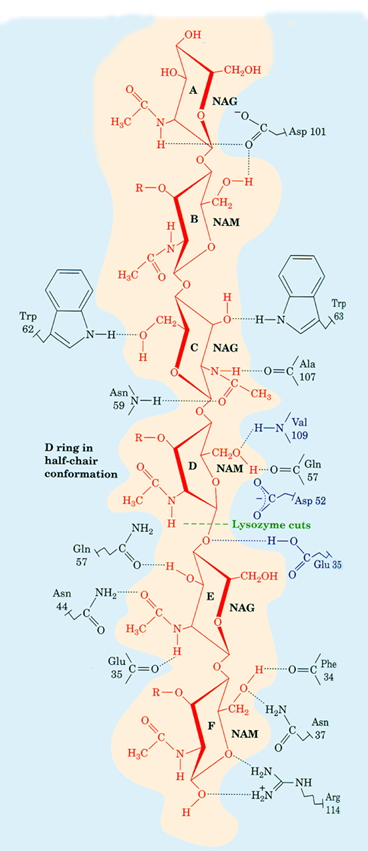
จากที่กล่าวมาแล้วว่าเอนไซม์แต่ละชนิดมีความจำเพาะเจาะจงที่จะเร่งเฉพาะปฏิกิริยาของซับสเตรตที่มีโครงสร้างที่เหมาะสำหรับตัวมันเท่านั้น การเข้าจับกับซับสเตรตทำให้เกิดเป็น โมเลกุลเชิงซ้อนซึ่งมีเอนไซม์จับกับซับสเตรต (enzyme-substrate complex) ซึ่งก็คือ ตัวกลาง (intermediate) ในปฏิกิริยานั่นเอง
การเกิดเป็นโมเลกุลเชิงซ้อนดังกล่าวนี้ได้ถูกนำ
เสนอโดย เวิร์ทซ์ (Charles Adolphe Wurtz) ในปี พ.ศ. 2423
 |
Charles Adolphe Wurtz
การจับกันระหว่างซับสเตรตกับเอนไซม์นอกจากจะต้องอาศัยการเข้ากันทางรูปร่างแล้ว ยังต้องอาศัยการเข้ากันทางด้านคุณสมบัติทางเคมีอีกด้วย เพื่อให้มีแรงจับกันชนิดอ่อน (weak interaction) เช่น พันธะไฮโดรเจน (hydrogen bond)
แรงไฮโดรโฟบิก (hydrophobic interaction) และแรงแวนเดอร์ วาลส์ (Van der
Waals interaction) เกิดขึ้นระหว่างแขนงข้างของกรดอะมิโนในบริเวณเร่งของเอนไซม์กับซับสเตรต ในจำนวนมากเพียงพอที่จะสามารถยึดตัวเข้าทำปฏิกิริยาเอาไว้ได้แน่น
นอกจากนี้การจับกันอย่างพอเหมาะระหว่างเอนไซม์และซับสเตรตด้วยแรงจับอย่างอ่อน ยังอาจทำให้โครงรูปในบริเวณเร่งของเอนไซม์มีการเปลี่ยนแปลงไปเล็กน้อย เพื่อให้สามารถจับกับซับสเตรตได้กระชับขึ้น
(induce fit model) กลไกการเปลี่ยนแปลงโครงรูปในบริเวณเร่งของเอนไซม์นี้ได้ถูกนำเสนอ ครั้งแรกโดย โคชแลนด์ (Daniel Koshland) ในปี พ.ศ. 2501
 |
Daniel Koshland