จากที่กล่าวในบทที่แล้วว่าเอนไซม์จะจับกับซับสเตรต แล้วเกิดเป็นโมเลกุลเชิงซ้อนของเอนไซม์กับซับสเตรต (enzyme-substrate complex) การจับกันระหว่างซับสเตรตกับเอนไซม์นอกจากจะต้องอาศัยการเข้ากันทางรูปร่างแล้ว ยังต้องอาศัยการเข้ากันทางด้านคุณสมบัติทางเคมีอีกด้วย เพื่อให้มีแรงจับชนิดอ่อน (weak interaction) เช่น พันธะไฮโดรเจน (hydrogen bond) แรงไฮโดรโฟบิก (hydrophobic interaction) และแรงแวนเดอร์ วาลส์ (Van der Walls interaction) เกิดขึ้นระหว่างกรดอะมิโนในบริเวณเร่งของเอนไซม์กับซับสเตรต กระบวนการที่สำคัญในขั้นตอนนี้มีกลไกที่สำคัญสามกลไก ดังนี้
1. การเร่งแบบกรดหรือเบสทั่วไป (general acid-base catalysis)
2. การเร่งแบบเกิดพันธะโควาเลนต์ (covalent catalysis)
3. การเร่งโดยไอออนของโลหะ (metal ion catalysis)
ในบริเวณเร่งของเอนไซม์จะมีแขนงข้างกรดอะมิโนจำนวนหนึ่งที่ทำหน้าที่ในการให้หรือรับ โปรตอนและอิเล็คตรอนอยู่ด้วย การถ่ายทอดโปรตอนและอิเล็คตรอนระหว่างแขนงข้างกรดอะมิโนและหมู่ต่างๆ ของเอนไซม์และซับสเตรต ทำให้เกิดสารตัวกลางที่มีประจุซึ่งจะอยู่ตัวได้เพียงชั่วขณะ
การที่สารดังกล่าวมีประจุอยู่ในตัวได้เพียงชั่วขณะ
จะทำให้มีการเปลี่ยนแปลงทางเคมีไปในทิศทาง
ที่ผลักดันให้ปฏิกิริยาดำเนินไปข้างหน้า ส่งผลให้
ปฏิกิริยาดำเนินได้เร็วขึ้น
ตัวอย่างเอนไซม์ที่มีการเร่งปฏิกิริยาแบบกรดเบสทั่วไป คือ ไคโมทริปซิน
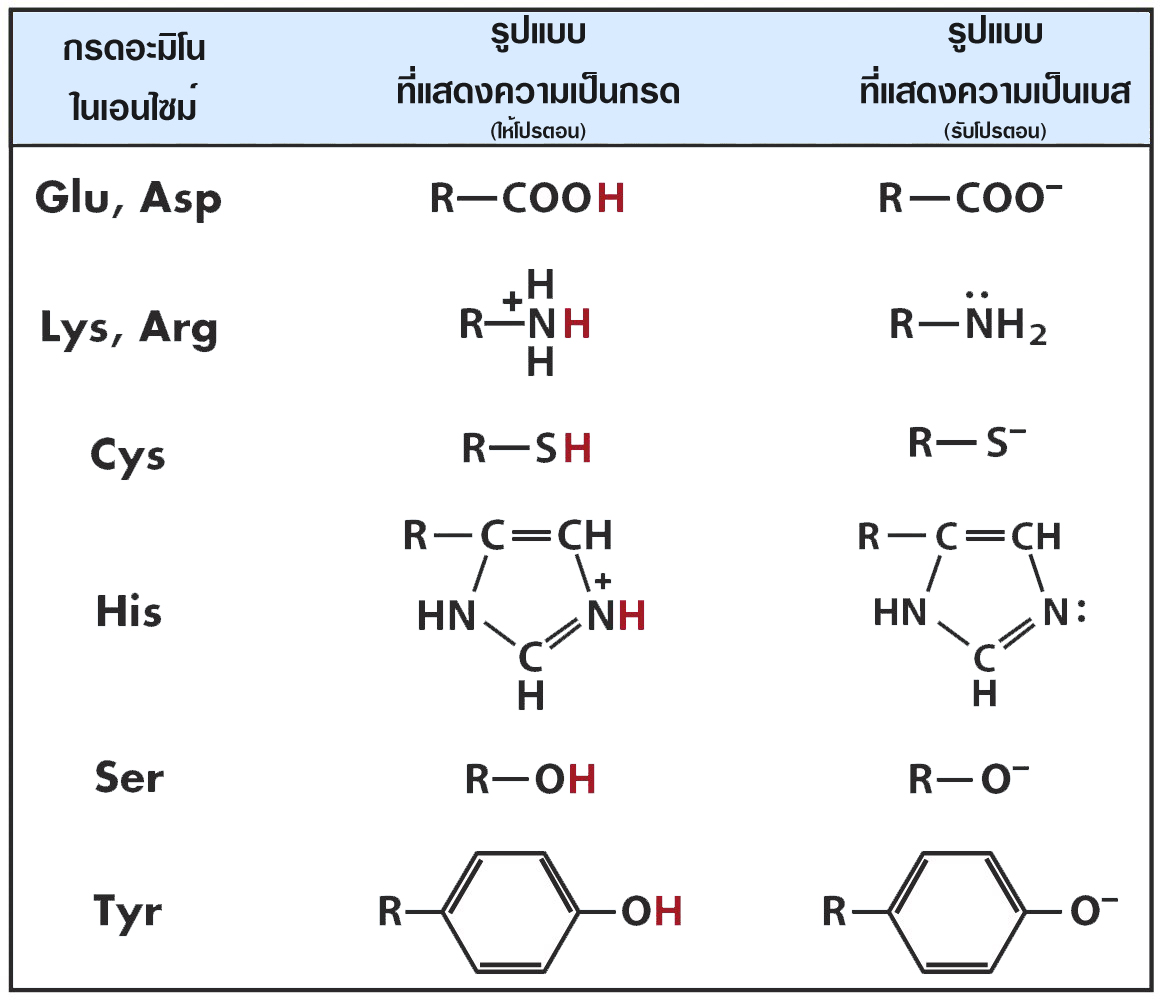
ตารางแสดงหมู่ฟังก์ชันของกรดอะมิโน
ที่แสดงคุญสมบัติความเป็นกรดและเบส
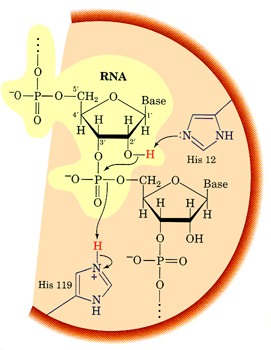
ภาพแสดงการจับกันระหว่างเอนไซม์และซับสเตรตแบบกรดเบส
บริเวณที่ลงสีเหลืองคือ บริเวณของโมเลกุลซับสเตรต บริเวณสีส้มแดง คือ บริเวณเร่งของเอนไซม์ จะเห็นได้ว่ามีความเหมาะเจาะระหว่างบริเวณเร่งของเอนไซม์กับรูปร่างของซับสเตรต ที่จับกันได้ดี จนเกิดเป็นสารประกอบเชิงซ้อนระหว่างเอนไซม์กับซับสเตรตที่ทำให้เกิดการเร่งปฏิกิริยาแบบกรดเบส
ซับสเตรตเพียงชั่วคราว ซึ่งจะมีการเปลี่ยนแปลงทางเคมีต่อไปจนในที่สุด
ได้เป็นเอนไซม์กับผลผลิตของปฏิกิริยาออกมา
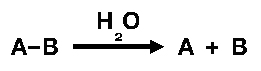
ตัวอย่าง เช่น การสลายสาร A-B ด้วยน้ำ
เมื่อมีเอนไซม์ซึ่งมีกลไกการเร่งปฏิกิริยาเป็นแบบ "การเร่งแบบเกิดพันธะโควาเลนต์ชั่วคราว" จะเกิดปฏิกิริยา โดยให้มีหมู่ x: เป็นหมู่ที่เกิดพันธะโควาเลนต์แบบชั่วคราวแล้วเกิดการสลาย A-B ด้วยน้ำได้ดังนี้
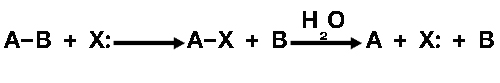
ไอออนิกระหว่างไอออนโลหะที่จับอยู่กับเอนไซม์กับซับสเตรต ไอออนโลหะยังมีส่วนร่วมในปฏิกิริยาออกซิเดชัน -รีดักชัน ในบริเวณเร่งของเอนไซม์อีกด้วย
ตัวอย่างไอออนโลหะที่มีส่วนช่วยในการเร่งปฏิกิริยา
Fe2+/Fe3+ Cu2+ Zn2+ Mn2+ และ Co2+
ตัวอย่างไอออนในเอนไซม์ที่อยู่บริเวณที่ช่วยเร่งให้ปฏิกิริยาเคมี
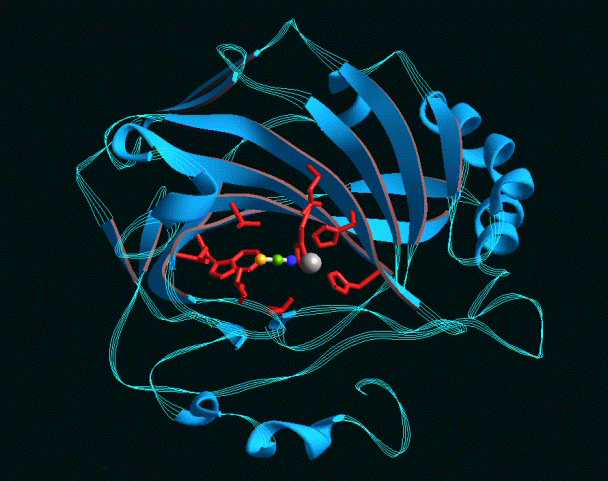 |
เอนไซม์คาร์บอนิกแอนไฮเดรส มี Zn2+(วงกลมสีเทา)
อยู่ในบริเวณเร่ง
ตัวอย่างของเอนไซม์ที่มีการเร่งโดยไอออนของโลหะ ได้แก่
คาร์บอกซีเปปติเดส มี Zn2+ ช่วยเร่งปฏิกิริยา และ ไซโตโครม ซี ออกซิเดส ที่มี Cu 2+ช่วยในการเร่งปฏิกิริยา เป็นต้น
ตัวอย่างปฏิกิริยาเคมี
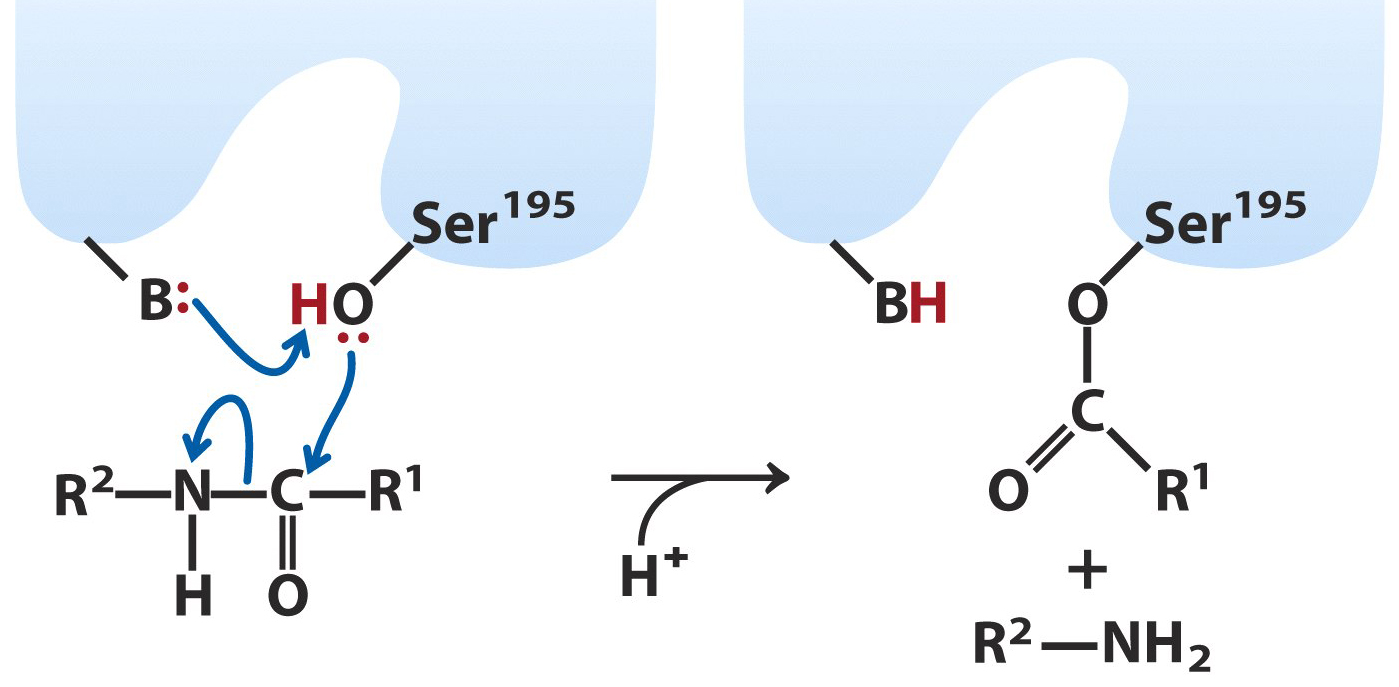 |
เอนไซม์ไคโมทริปซิน จะเกิดการเร่งปฏิกิริยาเคมี โดยการสร้างพันธะโควาเลนต์
แบบชั่วคราวกับซับสเตรต โดยมีกรดอะมิโนที่สำคัญคือ เซอรีนตัวที่ 195

