จลศาสตร์ของเอนไซม์ (enzyme kinetics) คือ การศึกษาอัตราเร็วของปฏิกิริยา (reaction rate) และการเปลี่ยนแปลงอัตราเร็วของปฏิกิริยาเมื่อมีการเปลี่ยนแปลงปัจจัยบางอย่าง เพื่อทำความเข้าใจกลไกการทำงานของเอนไซม์นั้นๆได้
กิจกรรมหรือการทำงาน (activity) ของเอนไซม์ นอกจากจะขึ้นกับตัวเอนไซม์และซับสเตรตเองแล้ว ปัจจัยภายนอกอีกหลายอย่างก็มีผลต่อการทำงานของมันด้วย โดยจะอธิบายในภายหลัง (เรื่อง ปัจจัยที่มีผลต่ออัตราเร็วของปฏิกิริยา)
ปฏิกิริยาที่มีเอนไซม์เป็นตัวเร่งและมีซับสเตรตเพียงหนึ่งตัวสามารถแบ่ง
ออกเป็นปฏิกิริยาย่อยซึ่งดำเนินต่อเนื่องกันไปดังนี้

จากสมการข้างบน (ซึ่งเป็นสมการโดยทั่วไป) ปฏิกิริยาขั้นแรกเป็นปฏิกิริยาที่ทวนกลับได้โดยที่โมเลกุลเชิงซ้อนซึ่งมีเอนไซม์จับกับซับสเตรต (ES) เป็นโมเลกุลที่ไม่มีพันธะโควาเลนต์ระหว่างเอนไซม์กับซับสเตรตและสามารถแยกสลายกลับเป็นเอนไซม์ (E) และซับสเตรต (S) ได้อย่างรวดเร็ว สำหรับปฏิกิริยาในขั้นที่สองมีการเปลี่ยนแปลงรูปร่างของโมเลกุลเกิดขึ้น ในโมเลกุลเชิงซ้อนซึ่งมีเอนไซม์จับกับซับสเตรตทำให้ได้ผลิตภัณฑ์ ซึ่งจะแยกตัวออกมาจากเอนไซม์ในที่สุด และเอนไซม์ก็จะสามารถกลับมาจับกับซับสเตรตตัวใหม่ได้ จะเห็นได้ว่าเอนไซม์เริ่มต้นและเอนไซม์เมื่อปล่อยผลิตภัณฑ์แล้ว คือเอนไซม์ที่ว่างเปล่า ซึ่งพร้อมจะเร่งปฏิกิริยาเมื่อจับกับซับสเตรตได้เหมือนกัน
ค่า k+1 k-1 และ k2 คือ ค่าคงที่ของอัตราความเร็ว (rate constants) ของปฏิกิริยาข้างต้นทำให้หาหน่วยของค่า k ต่างๆได้ดังนี้
มีการเปลี่ยนแปลงรูปร่างไปเป็นสารใหม่หรือไม่
ในตอนเริ่มต้นของปฏิกิริยา
โมเลกุลเชิงซ้อนซึ่งมีเอนไซม์จับกับซับสเตรต จะมีปริมาณเพิ่มมากขึ้น ในระยะนี้ปฏิกิริยาส่วนมากจะอยู่ในขั้นแรกและเรียกว่าเป็น
ระยะก่อนสภาวะคงที่ (pre-steady state) ซึ่งเป็นช่วงเวลาสั้นๆ เท่านั้น ต่อมาเมื่อโมเลกุลเชิงซ้อนซึ่งมีเอนไซม์จับกับซับสเตรตมีความเข้มข้นสูงพอสมควร
ปฏิกิริยาขั้นที่สองจะเกิดได้มากขึ้น เนื่องจากอัตราเร็วเป็นสัดส่วนโดยตรงกับความเข้มข้นของโมเลกุลเชิงซ้อนนั้น
เมื่อถึงระยะที่ โมเลกุลเชิงซ้อนซึ่งมีเอนไซม์จับกับซับสเตรตถูกสร้างขึ้นมาด้วยอัตราเร็วเท่าที่กับสลายไปเป็นเอนไซม์และผลิตภัณฑ์
ความเข้มข้นของโมเลกุลเชิงซ้อนของเอนไซม์กับซับสเตรตจะมีความคงที่ระยะนี้เรียกว่า
ระยะสภาวะคงที่ (steady state) ปฏิกิริยาเอนไซม์จะคงที่อยู่เกือบตลอดเวลา
เมื่อปฏิกิริยาอยู่ในสภาวะคงที่ โมเลกุลเชิงซ้อนซึ่งมีเอนไซม์จับกับซับสเตรต
จะมีค่าคงที่ของอัตราเร็วค่าหนึ่ง (k+1) และสามารถแยกสลายได้เป็นสองทาง
คือกลับไปเป็นเอนไซม์และซับสเตรต โดยจะได้ค่าคงที่ของอัตราเร็วอีกค่าหนึ่ง
(k-1) หรือ ปฏิกิริยาอาจดำเนินไปจนได้เอนไซม์และผลิตภัณฑ์ของปฏิกิริยา
ซึ่งมีค่าคงที่ของ อัตราเร็วอีกค่าหนึ่ง(k2 ) ดังนั้นโมเลกุลเชิงซ้อนซึ่งมีเอนไซม์จับกับซับสเตรต
และเอนไซม์กับซับสเตรต จึงมีความสัมพันธ์กันประหนึ่งว่ามีสมดุลทางเคมีกันอยู่
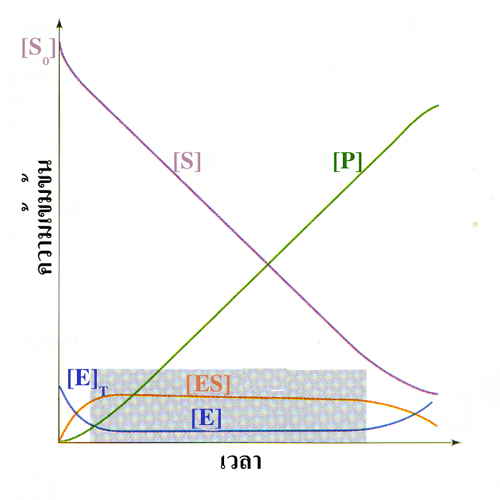
ภาพแสดงการเปลี่ยนแปลงของปฏิกิริยาที่มีเอนไซม์
[E] คือ ความเข้มข้นของเอนไซม์ที่ว่างเปล่า
[ES] คือ ความเข้มข้นของสารประกอบเชิงซ้อนเอนไซม์กับซับสเตรต
[E]t คือ ค่าความเข้นข้นของเอนไซม์ทั้งหมด ซึ่งเท่ากับ [E] + [ES]
[S0] คือ ความเข้มข้นของซับสเตรตเริ่มต้น
[S] คือ ความเข้มข้นซับสเตรตในเวลาต่างๆ
[P] คือ ความเข้มข้นผลผลิตในเวลาต่างๆ
การวัดอัตราเร็วของปฏิกิริยาอาจทำโดยการวัดความเข้มข้นของซับสเตรต หรือของผลผลิตที่เวลาต่างๆ วิธีการอย่างหนึ่งที่นิยมใช้คือ วิธีการทาง สเปคโตรโฟโตเมตรี (spectrophotometry) ในปฏิกิริยาที่เร่งโดยเอนไซม์มักพบว่า ในระยะแรกๆ อัตราเร็วของปฏิกิริยาจะให้กราฟที่เป็นเส้นตรง แสดงว่ามีปฏิกิริยาเกิดขึ้นอย่างสม่ำเสมอ แต่ในระยะหลังการเพิ่มของปริมาณผลิตผลจะค่อยๆ ช้าลงและในที่สุดอาจหยุดเลย ด้วยเหตุนี้การวัดอัตราความเร็วของปฏิกิริยาเอนไซม์จะใช้ช่วงแรกของกราฟที่เป็น เส้นตรงซึ่งเรียกว่า อัตราเร็วเริ่มต้น (initial velocity : Vi)
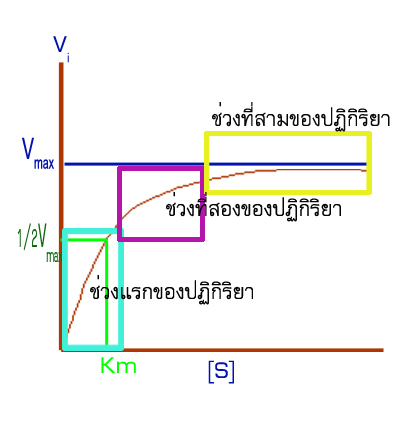
กราฟแสดงความสัมพันธ์ระหว่างอัตราเร็วเริ่มต้นกับความเข้มข้น
ของซับสเตรตเริ่มต้น
สมการมิเคลิส-เมนเทน (Michaelis-Menten equation) คือ
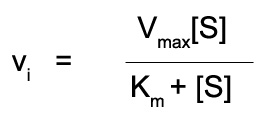
และค่า Km หาได้จาก
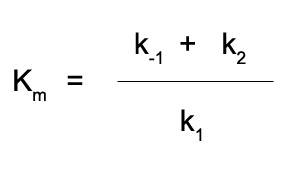
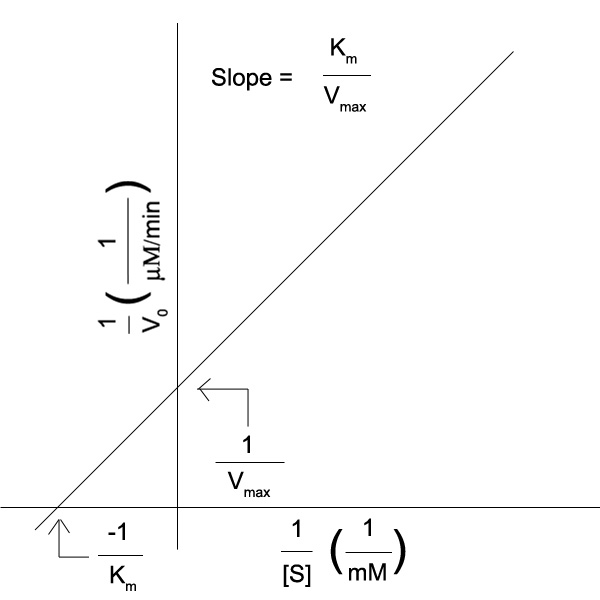
การหาอัตราความเร็วสูงสุดและค่าความเข้มข้นของซับสเตรต ที่ให้ อัตราความเร็วเป็นครึ่งหนึ่งของความเร็วสูงสุดอาจหาได้จากกราฟ แสดงความสัมพันธ์ระหว่างอัตราเร็วเริ่มต้นของปฏิกิริยาเอนไซม์กับความเข้มข้นของซับสเตรต หรือหาได้จากกราฟไลน์วีเวอร์-เบิร์ก (Lineweaver-Burk plot) ที่สามารถคำนวณค่าทั้งสองได้จากจุดตัดบนแกนตั้ง แกนนอน และจากความชันของเส้นตรงจากกราฟ
การคำนวณหาค่า Vmax โดยใช้กราฟไลน์วีเวอร์-เบิร์ก นี้จะกลับสมการของสมการมิเคลิส-เมนเทน กล่าวคือ
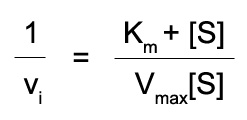
เมื่อนำไปวาดกราฟ จะได้กราฟที่มีลักษณะดังต่อไปนี้
1. ถ้าซับสเตรตหมด จะเกิดอะไรขึ้น กราฟจะเป็นอย่างไร?
2. ทำไมเมื่อเราเพิ่มปริมาณความเข้มข้นของเอนไซม์
ไปถึงระดับหนึ่งแล้ว อัตราเร็วก็ไม่สามารถเพิ่มขึ้นได้อีก?

