| |
พันธะไฮโดรเจนระหว่างโมเลกลุของน้ำมีความสำคัญอย่างไร |

ในสิ่งมีชีวิตโดยเซลล์สิ่งมีชีวิตมีน้ำเป็นองค์ประกอบประมาณร้อยละ 70 น้ำจัดเป็นสารที่มี
คุณสมบัติพิเศษหลายอย่าง ซึ่งคุณสมบัติที่พิเศษนี้เกิดจากโครงสร้างของน้ำที่เหมาะสม
ในการทำหน้าที่ในร่างกายสิ่งมีชีวิต
์ น้ำเป็นโมเลกุลที่มีขั้ว ประกอบด้วยบริเวณที่เป็นขั้วลบอ่อนๆ 2 บริเวณ และขั้วบวกอ่อนๆ
2 บริเวณ ทำให้เกิดพันธะระหว่างโมเลกุลของน้ำ พันธะดังกล่าวคือพันธะไฮโดรเจนที่ยึด
ระหว่างขั้วบวกที่บริเวณอะตอมไฮโดรเจนของน้ำโมเลกุลหนึ่งกับขั้วลบบริเวณอะตอม
ออกซิเจนของน้ำอีกโมเลกุลหนึ่ง น้ำ 1 โมเลกุลสามารถสร้างพันธะไฮโดรเจนกับน้ำโมเลกุล
อื่นได้ถึง 4 โมเลกุล ถึงแม้ว่าแต่ละพันธะจะยึดกันด้วยแรงที่อ่อน แต่เมื่อคำนึงถึงจำนวนพันธะ
ไฮโดรเจนที่ยึดโมเลกุลของน้ำทั้งหมดเข้าด้วยกันแล้วก็จะมีความแข็งแรงมาก ทำให้น้ำ
มีแรงตึงผิว (surface tension) สูง ความร้อนจำเพาะ (specific heat) สูง จึงทำให้ต้องใช้
ความร้อนสูงในการทำให้น้ำระเหยเป็นไอ ก่อนที่น้ำจะแข็งตัวปริมาตรของน้ำจะเพิ่มขึ้น ดังนั้น
น้ำแข็งจึงมีความหนาแน่นน้อยกว่าน้ำที่มีสถานะเป็นของเหลว
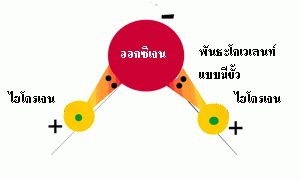
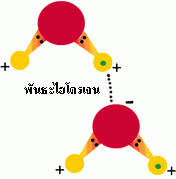
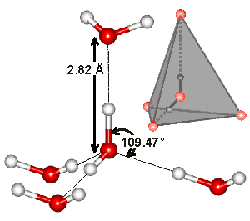
รูปที่ 2.9 ประจุในโมเลกุลน้ำและพันธะไฮโดรเจนระหว่างโมเลกุลน้ำที่อยู่ใกล้กัน
ที่มา |
http://www.lsbu.ac.uk/water/hbond.html
ในท่อเล็กๆ ได้ (capillary movement) และสามารถเป็นตัวทำละลายที่ดีสำหรับอิออนและ
โมเลกุลที่มีขั้ว (polar molecule) โมเลกุลที่ละลายในน้ำได้เรียกว่า ไฮโดรฟิลิก (hydrophilic)
หรือ พวกที่ชอบน้ำ โมเลกุลที่ไม่มีขั้ว (nonpolar molecule) ไม่สามารถละลายในน้ำและ
แยกตัวออกจากน้ำเรียกว่า ไฮโดรโฟบิก (hydrophobic) หรือ พวกที่ไม่ชอบน้ำ
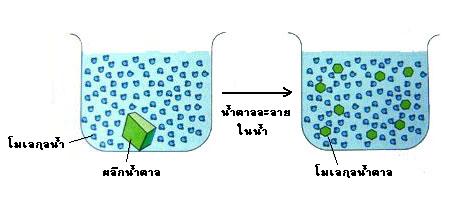
รูปที่ 2.10 การละลายน้ำของน้ำตาลเนื่องจากคุณสมบัติไฮโดรฟิลิก
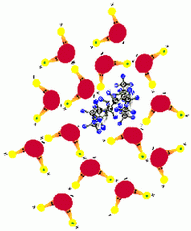
รูปที่ 2.11 โมเลกุลที่ไม่มีขั้วไม่สามารถละลายในน้ำ
และเกิดการจับกลุ่มระหว่างโมเลกุลไม่มีขั้ว
และเกิดการจับกลุ่มระหว่างโมเลกุลไม่มีขั้ว
ที่มา |
น้ำบริสุทธิ์ จำนวน H+ เท่ากับ OH- ในสารละลายที่มีปริมาณ H+ มากกว่า OH- จัดเป็น
สารละลายกรด (acid) สารละลายที่มีปริมาณ OH- อิออน มากกว่า H+ เรียกว่าสารละลายเบส
(base)
pH เป็นค่าที่แสดงถึง สัดส่วนระหว่างปริมาณ H+ ต่อ OH- สารละลายกรดมี pH
น้อยกว่า 7 และสารละลายเบสมี pH มากกว่า 7 สารละลายเป็นกลาง (neutral) มี pH
เท่ากับ 7 ปฏิกิริยาเคมีเกือบทั้งหมดที่เกิดขึ้นในร่างกายสิ่งมีชีวิต จะอยู่ในช่วง pH เป็นกลาง