|

พันธะเพปไทด์ระหว่างกรดอะมิโน ทำให้กรดอะมิโนเรียงตัวต่อกันเป็นสายยาว แต่สายพอลิเพปไทด์ในโปรตีนไม่ได้เป็นสายที่ยืดออกเป็นเส้นตรง แต่จะม้วนหรือพับเข้าหากันทำให้โปรตีนมีโครงสร้างสามมิติที่เป็นเอกลักษณ์และมีคุณสมบัติทำงานได้จำเพาะอย่าง
โครงสร้างที่เป็นเอกลักษณ์ของโปรตีนเป็นตัวกำหนดหน้าที่ของโปรตีน การทำงานของโปรตีนทุกตัวขึ้นกับความสามารถในการจดจำและความสามารถในการจับกับโมเลกุลบางชนิด เช่น การที่โปรตีนในระบบภูมิคุ้มกันจับกับสิ่งแปลกปลอม หรือเอนไซม์จับกับตัวเข้าทำปฏิกิริยาที่จำเพาะ เป็นต้น
ไมโอโกลบิน (myoglobin) และฮีโมโกลบิน (hemoglobin) เป็นโปรตีนที่ได้มีการศึกษาโครงสร้างอย่างละเอียดเป็นอันดับแรกๆ ไมโอโกลบินเป็นโมเลกุลที่มีลักษณะกลมภายในตัน ประกอบไปด้วยกรดอะมิโน 153 ตัว สายพอลิเพปไทด์ของมันมีการขดตัวโดยมีทั้งส่วนที่เป็นแท่งและส่วนที่ขดงอ ส่วนที่เป็นแท่งมีลักษณะเป็นเกลียว ซึ่งบางเกลียวก็เป็นเกลียวสั้น บางเกลียวก็ยาว เนื้อที่ภายในก้อนกลมเพียงพอให้โมเลกุลของน้ำอยู่ได้เพียงสี่โมเลกุล แขนงข้างของกรดอะมิโนที่มีความเป็นขั้วจะอยู่ตามผิวภายนอก ส่วนแขนงข้างของกรดอะมิโนที่โมเลกุลแสดงความไม่มีขั้วจะฝังตัวเองอยู่ภายในโปรตีน กรดอะมิโนโพรลีนจะอยู่ตามส่วนที่ขดงอของโมเลกุล การศึกษาโครงสร้างของฮีโมโกลบินพบว่าเป็นโปรตีนที่ประกอบด้วยสายพอลิเพปไทด์หลายสาย แต่ละสายมีการขดตัวเป็นก้อนกลมและเกาะกันเป็นโมเลกุลเดียวที่สามารถทำงานได้อย่างมีประสิทธิภาพ ลักษณะการขดตัวของฮีโมโกลบินมีความคล้ายคลึงกับไมโอโกลบินมาก คือมีปริมาณของเกลียว หรือลักษณะการขดงอใกล้เคียงกัน จึงอาจกล่าวได้ว่าโครงสร้างที่คล้ายคลึงกันทำหน้าที่ได้เหมือนกัน
|
ภาพที่ 4.13 ภาพแสดงโครงสร้างสามมิติของฮีโมโกลบิน
|
ดังนั้นในการศึกษาโครงสร้างของโปรตีนชนิดอื่นๆ เพื่อให้เข้าใจถึงหน้าที่การทำงาน จึงจำเป็นต้องศึกษาโครงรูปในส่วนต่างๆ ของโปรตีน ว่าการขดตัวในแต่ละช่วงของสายพอลิเพปไทด์นั้นมีลักษณะอย่างไรบ้าง เช่น ขดเป็นเกลียวหรือเรียงตัวขนานกันเป็นแผ่นอย่างมีระเบียบแบบแผน หรือขดงออย่างไม่เป็นระเบียบ และโครงรูปในแต่ละส่วนนั้นมีการยึดเหนี่ยวกันไว้ในลักษณะใด เพื่อให้เข้าใจโครงสร้างสามมิติของโปรตีน แต่อย่างไรก็ตามการศึกษาเพื่อให้เข้าใจโครงสร้างสามมิติแต่เพียงอย่างเดียวไม่เพียงพอที่จะใช้อธิบายกลไกการทำงานของโปรตีนนั้นๆ การศึกษาการเรียงตัวของกรดอะมิโนในสายพอลิเพปไทด์จะช่วยให้เราเข้าใจกลไกการเข้าจับของโปรตีนกับชีวโมเลกุลอื่น โดยอาศัยคุณสมบัติทางเคมีของแขนงข้างของกรดอะมิโนในบริเวณที่ทำงานได้ (active site) ของโปรตีน นอกจากนี้ลำดับการเรียงตัวของกรดอะมิโนยังมีความสำคัญในแง่ที่มันเป็นตัวกำหนดลักษณะการขดงอของส่วนต่างๆ ในสายพอลิเพปไทด์อีกด้วย
ดังนั้นขั้นตอนในการดูลักษณะโครงสร้างของโปรตีนจึงแบ่งออกเป็นหลายระดับตามความซับซ้อน หากเป็นการดูลำดับการเรียงตัวของกรดอะมิโนในสายพอลิเพปไทด์โดยยังไม่สนใจรูปร่างของโปรตีน เราเรียกว่าเป็นการศึกษาโครงสร้างในระดับพื้นฐาน (primary structure) หากเราสนใจลักษณะการขดงอที่มีระเบียบในแต่ละส่วนของสายพอลิเพปไทด์ เราเรียกว่าเป็นการศึกษาโครงสร้างในระดับที่สอง (secondary structure) ส่วนการดูลักษณะโครงสร้างโปรตีนว่าแต่ละส่วนในสายพอลิเพปไทด์มีการยึดเหนี่ยวเข้าด้วยกันอย่างไรจึงทำให้เกิดเป็นโครงสร้างสามมิติที่เป็นเอกลักษณ์ของโปรตีนในสภาพธรรมชาติหรือใกล้เคียงสภาพธรรมชาติ เป็นการดูลักษณะโครงสร้างระดับที่สาม (tertiary structure) แต่ถ้าหากโปรตีนนั้นประกอบไปด้วยสายพอลิเพปไทด์มากกว่าหนึ่งสายมารวมกันเป็นโครงสร้างเดียว เราจำเป็นต้องดูลักษณะของกลุ่มก้อนที่มีการยึดเหนี่ยวหน่วยโครงสร้างระดับที่สามหลายหน่วยเข้าไว้ด้วยกัน ซึ่งเราเรียกว่าเป็นโครงสร้างระดับที่สี่ (quaternary structure) ของโปรตีน
โครงสร้างระดับพื้นฐานของโปรตีนแต่ละชนิดมีความจำเพาะไม่เหมือนกับโปรตีนชนิดอื่นๆ การดูลักษณะโครงสร้างระดับนี้ของโปรตีนมีความสำคัญอย่างยิ่ง เพราะมันเป็นตัวกำหนดว่าโครงสร้างในระดับสูงขึ้นไปควรจะเป็นอย่างไร แต่ความรู้เกี่ยวกับโครงสร้างระดับนี้ก็ยังไม่เพียงพอที่จะอธิบายการทำงานของโปรตีนได้
|
ภาพที่ 4.14 โครงสร้างระดับพื้นฐานของโปรตีน
|
โครงสร้างระดับที่สองของโปรตีนชี้ให้เห็นการม้วน การขด หรือการทบไปทบมาเป็นแผ่นพลีท หรือเป็นแผ่นบิดที่มีความเป็นระเบียบแบบแผน ซึ่งปรากฏอยู่ในแต่ละช่วงของสายพอลิเพปไทด์ โครงสร้างระดับนี้อยู่ตัวได้ดีเนื่องจากมีพันธะไฮโดรเจนเป็นตัวจัดระเบียบ
โครงสร้างระดับที่สองที่พบมากได้แก่ เกลียวแอลฟา( α-helix) และ แผ่นพลีทบีตา( ß-pleated sheet)
ในเกลียวแอลฟา สายพอลิเพปไทด์จะม้วนตัวเป็นเกลียวแบบเวียนขวา โดยที่หนึ่งรอบเกลียวจะมีกรดอะมิโน 3.6 ตัว และมีระยะระหว่างเกลียวเท่ากับ 5.4 อังสตรอม เกลียวแอลฟาอยู่ตัวได้ดีเพราะมีพันธะไฮโดรเจนระหว่างกลุ่ม CO ในพันธะเพปไทด์ของกรดอะมิโนตัวหนึ่งกับกลุ่ม NH ในพันธะเพปไทด์ของกรดอะมิโนที่อยู่ถัดไปอีก 4 ตัว ส่วนแขนงข้างของกรดอะมิโนจะชี้ออกสู่ด้านนอกรอบตัวเกลียว
|
|
ภาพที่ 4.15 โครงสร้างระดับที่สองของโปรตีน |
โปรตีนบางตัวมีปริมาณเกลียวแอลฟามาก แต่บางชนิดมีน้อยหรือไม่มีเลย ส่วนใหญ่โปรตีนที่ทำหน้าที่เกี่ยวกับโครงสร้าง เช่น โปรตีนเส้นใยมักจะมีปริมาณเกลียวแอลฟามาก (เช่น คอลลาเจน) ส่วนโปรตีนทั่วไปที่ไม่เป็นเส้นใย เกลียวของโปรตีนอาจเป็นเกลียวเวียนขวาในลักษณะอื่น หรืออาจเป็นเกลียวแอลฟาที่บิดเบี้ยวไปบ้าง
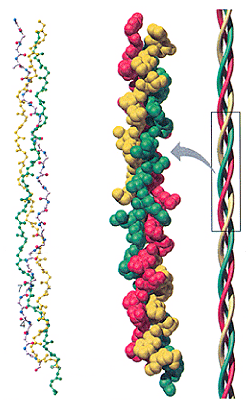
ภาพแสดงโครงสร้างของคอลลาเจน
เกลียวหลายๆ อันในโปรตีนอาจหมุนรอบตัวเองร่วมกันเป็นเกลียวซ้อนเกลียว ( α-helical coiled coil) คล้ายการควั่นเชือก ซึ่งจะช่วยเพิ่มความแข็งแรงและความเหนียวให้กับโครงสร้างมากขึ้น เช่น โปรตีนเคราติน (keratin) ในเส้นผม โปรตีนโทรโปไมโอซิน (tropomyosin) ในเส้นใยกล้ามเนื้อ
ในแผ่นพลีทบีตา สายพอลิเพปไทด์จะขดตัวอยู่ในลักษณะขนานกัน ซึ่งอาจมีทิศทางการเรียงตัวของกรดอะมิโนที่มีหมู่อะมิโนอิสระและกรดอะมิโนที่มีหมู่คาร์บอกซิลอิสระไปในทางเดียวกัน (parallel) หรือมีทิศสวนทางกัน (antiparallel) ก็ได้ โดยมีพันธะไฮโดรเจนระหว่างกลุ่ม CO และกลุ่ม NH ของสายพอลิเพปไทด์ที่วิ่งเคียงคู่กันนั้น กรดอะมิโนแต่ละตัวบนสายพอลิเพปไทด์เรียงตัวกันด้วยระยะ 3.5 อังสตรอม แขนงข้างของกรดอะมิโนจะชี้ออกสู่ด้านล่างและด้านบนของสายพอลิเพปไทด์
์

ในโปรตีนชนิดเส้นใยจะพบว่าสายพอลิเพปไทด์ที่อยู่เคียงคู่กันจะวิ่งสวนทางกัน แต่ในโปรตีนชนิดก้อนกลม สายพอลิเพปไทด์ที่อยู่เคียงคู่กันอาจวิ่งไปในทางเดียวกันหรือสวนทางกันก็ได้ และแผ่นพลีทบีตาในโปรตีนที่ไม่เป็นเส้นใยมักจะไม่อยู่ในระนาบเดียวกันดังแผ่นพลีทที่ค่อนข้างสมบูรณ์อย่างที่ปรากฏในใยไหมหรือใยแมงมุม แต่จะบิดเล็กน้อยไปในทิศทางตามเข็มนาฬิกา
ในโปรตีนก้อนกลมมักจะพบว่าโครงสร้างระดับที่สอง เช่น เกลียวอัลฟา หรือแผ่นพลีทบีตาที่อยู่ใกล้กันรวมตัวกันเป็นโครงสร้างระดับที่สาม โดยมีส่วนอื่นๆ ของพอลิเพปไทด์เป็นสายต่อเชื่อมโยงระหว่างโครงสร้างที่ต่างๆ กันนั้น และพบว่าแขนงข้างในโครงสร้างระดับสองที่ใกล้เคียงกันจะอัดตัวกันแน่น
โครงสร้างระดับที่สามของโปรตีนประกอบด้วยโครงสร้างระดับที่สองหลายๆ ส่วนมารวมกัน โดยที่คุณสมบัติทางเคมีของกรดอะมิโนแต่ละตัวในโปรตีนจะเป็นตัวกำหนดว่าโครงสร้างระดับที่สองหลายๆ ส่วนนั้นจะยึดเหนี่ยวกันไว้ในลักษณะใด
โครงสร้างระดับที่สามของโปรตีนอาจมีลักษณะเป็นก้อนกลม (globular structure) หรือเป็นเส้นใย (fibrous structure) ก็ได้
แรงยึดเหนี่ยวในโมเลกุลที่ช่วยยึดสายพอลิเพปไทด์ให้มีโครงสร้างระดับที่สามที่เหมาะสมต่อหน้าที่ทางชีวภาพของโปรตีนนั้น ล้วนไม่ใช่พันธะโควาเลนต์ แต่เป็นแรงยึดเหนี่ยวที่มีพลังงานระดับต่ำ เช่น พันธะไฮโดรเจน แรงไฮโดรโฟบิก แรงแวนเดอร์วาลส์ และพันธะระหว่างประจุ
|
|
ภาพที่ 4.16 แรงยึดเหนี่ยวในโครงสร้างระดับที่สามของโปรตีน |
ถึงแม้ว่าพันธะที่ไม่ใช่โควาเลนต์เหล่านี้จะเป็นแรงดึงดูดอย่างอ่อนแต่ก็สามารถยึดโครงสร้างสามมิติของโปรตีนให้อยู่ตัวได้ ทั้งนี้เพราะแรงดึงดูดชนิดอ่อนเหล่านี้มีเป็นจำนวนมาก

โครงสร้างระดับที่สี่ของโปรตีนเป็นโครงสร้างที่ยึดเหนี่ยวหน่วยโครงสร้างระดับที่สามหลายหน่วยเข้าไว้ด้วยกันกลายเป็นโมเลกุลเดียว
หน่วยโครงสร้างระดับที่สามแต่ละหน่วยในโครงสร้างระดับที่สี่อาจเป็นหน่วยที่มีโครงสร้างแบบเดียวกันหรือต่างกันก็ได้ และจำนวนหน่วยโครงสร้างระดับที่สามอาจมีน้อยหรือมากก็ได้
|
ภาพที่ 4.17 โครงสร้างระดับที่สี่ของโปรตีน |
โปรตีนจะมีโครงสร้างสามมิติเป็นแบบใดนั้นขึ้นอยู่กับชนิดของกรดอะมิโนที่มาประกอบกันเป็นสายพอลิเพปไทด์และสภาวะความเป็นกรดด่างในเซลล์ที่มีผลต่อแรงยึดเหนี่ยวในโมเลกุล
การที่โครงสร้างสามมิติของโปรตีนขึ้นอยู่กับแรงดึงดูดชนิดอ่อน ทำให้โครงรูปของโปรตีนเปลี่ยนแปลงไปได้ง่ายเมื่อสภาพแวดล้อมเปลี่ยนแปลงไป ซึ่งอาจมีผลต่อการทำงานของโปรตีน
สภาพแวดล้อมที่รุนแรง เช่น อุณหภูมิสูง pH สูงหรือต่ำมากๆ หรือมีสารบางชนิด เช่น ยูเรีย และ กวานิดีนไฮโดรคลอไรด์ อาจทำลายแรงดึงดูดชนิดอ่อนเหล่านี้ ทำให้โครงสร้างของโปรตีนเปลี่ยนไปจนกระทั่งโปรตีนไม่สามารถทำหน้าที่ทางชีวภาพ ปรากฏการณ์เช่นนี้เรียกว่า การเสียสภาพของโปรตีน (denaturation)
ในบางกรณีโครงสร้างของโปรตีนที่เสียสภาพธรรมชาติไปแล้ว อาจกลับคืนสู่โครงร่างเดิมภายหลังการปรับสภาพแวดล้อมกลับให้เหมือนเดิม แต่ในบางกรณีโปรตีนที่เสียสภาพไม่อาจกลับมาเป็นโปรตีนที่สามารถทำหน้าที่เหมือนเดิมได้
 |
 |
|
การต้มไข่จะทำให้โปรตีนอัลบูมิน (albumin) ในไข่ขาวจับตัวกัน (coagulation) เป็นก้อนแข็งและเปลี่ยนกลับไปเป็นไข่ขาวเหลวๆ
อย่างเดิมไม่ได้ครับ |
|
 |
|
 |
|


