|

การยืดและหดตัวของกล้ามเนื้อเป็นการทำงานร่วมกันระหว่างโปรตีนแอกตินและไมโอซิน
การหดตัวและคลายตัวของกล้ามเนื้อ เป็นการทำงานร่วมกันระหว่างแอกตินและไมโอซิน ซึ่งเป็นโปรตีนที่ช่วยให้กล้ามเนื้อมีการหดตัวและคลายตัว เป็นผลให้อวัยวะสามารถเคลื่อนตัวและช่วยให้ร่างกายของเราสามารถเคลื่อนที่ไปไหนมาไหนได้
แอกตินเป็นโปรตีนซึ่งเป็นส่วนประกอบสำคัญของสายบาง โมเลกุลของแอกตินมีลักษณะกลม มีการจับตัวกันเป็นสายยาว และสายเหล่านี้จับกันเป็นเกลียวคู่ ในสายบางของกล้ามเนื้อยังมโปรตีนโทรโปนินและโทรโปไมโอซินเกาะอยู่ด้วยกับแอกติน มีหน้าที่ควบคุมการหดตัวและการคลายตัวของกล้ามเนื้อ
ไมโอซินเป็นโปรตีน มีส่วนหนึ่งที่มีลักษณะเป็นมัดประกอบด้วยหลายเส้นที่เรียกว่า"เส้นหนัก" เส้นหนักประกอบด้วยกลุ่มที่มีสองเส้นพันกันเป็นเกลียวหลายคู่ ที่ปลายข้างหนึ่งมี "หัว" ยื่นออกไปสองหัว แต่ละหัวมีโพลีเพปไทด์สองเส้น หัวมีคุณสมบัติเป็นเอนไซม์ ATPase ซึ่งเร่งการสลายตัวของ ATP เป็น ADP และฟอสเฟต
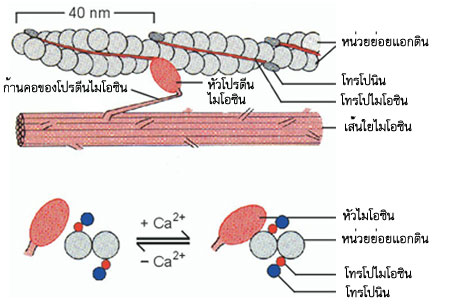
ภาพแสดงโครงสร้างของแอกตินและไมโอซิน
(nm คือความยาว 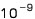 เมตร) เมตร)
ภาพแสดงการทำงานร่วมกันของแอกตินและไมโอซิน
แชพเพอโรนเป็นโปรตีนที่มีโครงสร้างซับซ้อน ช่วยให้โปรตีนที่สร้างขึ้นมาใหม่ม้วนพับจนได้โครงสร้างสามมิติที่ถูกต้อง
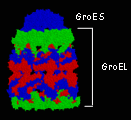
แชพเพอโรน (chaperone) เป็นโปรตีนที่มีโครงสร้างซับซ้อน ประกอบด้วยโปรตีนหลายหน่วยย่อย ทำหน้าที่ป้องกันการม้วนพับของสายพอลิเพปไทด์ที่เพิ่งถูกสร้างไม่ให้ม้วนผิดรูปแบบ ป้องกันไม่ให้มีการรวมตัวกันของสายพอลิเพปไทด์เกิดเป็นโปรตีนที่ไม่สามารถทำงานได้ และช่วยให้สายพอลิเพปไทด์ม้วนพับได้เป็นโครงสร้างที่ถูกต้อง แชพเพอโรนมีอยู่มากกว่า 50 ชนิด ตัวอย่างของแชพเพอโรนที่มีการศึกษาโครงสร้างแล้วเป็นอย่างดี ได้แก่ GroEL/GroES complex ใน E. coli
โครงสร้างของ GroEL/GroES complex มีลักษณะเป็นกรง มีขนาดกว้าง 8 นาโนเมตรและยาว 8.5 นาโนเมตร ประกอบด้วยหน่วยย่อยสองหน่วย คือ GroEL และ GroES นอกจากนี้ยังประกอบด้วยเอนไซม์ ATPase อีกด้วย
GroEL ประกอบด้วยวงแหวน 2 วง แต่ละวงประกอบขึ้นมาจากหน่วยย่อยทั้งสิ้น 7 หน่วยย่อยที่จัดเรียงตัวกัน สำหรับ GroES เป็นวงแหวนเดี่ยวรูปโดมที่ประกอบขึ้นมาจากหน่วยย่อย 7 หน่วยเช่นเดียวกัน
    |
GroEL (top) |
GroEL (side) |
GroEL/ES (top) |
GroEL/ES (side) |
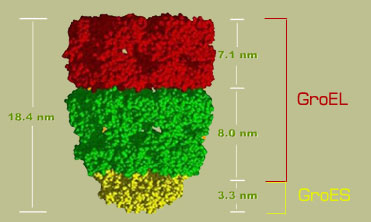
ภาพแสดงโครงสร้างของ GroEL/GroES complex
เอนไซม์ส่วนใหญ่เป็นโปรตีน มักจะทำงานร่วมกันเป็นกลุ่มของหน่วยย่อยทุติยภูมิ
เอนไซม์เป็นตัวเร่งปฏิกิริยาเคมีในสิ่งมีชีวิตที่มีประสิทธิภาพและความจำเพาะสูง ส่วนใหญ่เป็นสารประกอบจำพวกโปรตีน ในเซลล์ของสิ่งมีชีวิตทั่วไป เอนไซม์มักจะทำงานร่วมกันเป็นกลุ่มของหน่วยย่อยทุติภูมิ เรียกว่า ระบบมัลติเอนไซม์
เอนไซม์บางชนิดมีโครงสร้างไม่ซับซ้อน
ไม่มีหน่วยย่อย หรือมีหน่วยย่อยที่เหมือนกัน 2 หน่วย ได้แก่ อะไมเลส (amylase) ไลโซไซม์ (lysozyme) เปปซิน (pepsin) ทริปซิน (trypsin) เป็นต้น
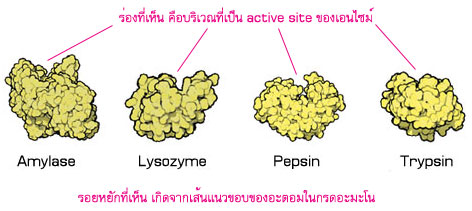
เอนไซม์บางชนิดมีขนาดใหญ่ไม่มาก ประกอบด้วยหน่วยย่อยที่ไม่เหมือนกัน (สีที่แตกต่างกัน แสดงหน่วยย่อยที่แตกต่างกัน) เช่น อัลโดเลส (aldolase) กลูตามีนซินธีเทส (glutamine synthetase) ไพรูเวทไคเนส (pyruvate kinase) ทริปโตแฟนซินเทส (tryptophan synthase)
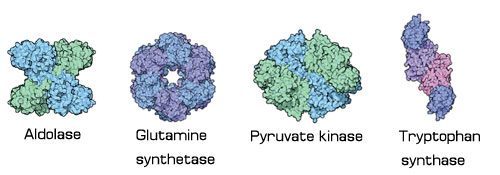
| เอนไซม์บางชนิดจะรวมเข้าไปอยู่ในโครงสร้างของระบบหรือกลุ่มโมเลกุลขนาดใหญ่ เช่น เอนไซม์ที่สำคัญที่อยู่ตรงเยื่อหุ้มชั้นในของไมโทคอนเดรีย (inner mitochondrial membrane) ตัวอย่างเช่น ATP synthase ซึ่งเป็นเอนไซม์ที่มีขนาดเส้นผ่าศูนย์กลางประมาณ 10 นาโนเมตร และสูงประมาณ 25 นาโนเมตร ประกอบด้วยโปรตีน 2 หน่วยใหญ่ๆ ได้แก่ Fo และ F1 |
|
หน่วยย่อย Fo เป็นโปรตีนที่แทรกตัวอยู่ภายในเยื่อหุ้มเซลล์ และมีลักษณะเป็นช่อง ซึ่งประกอบด้วยตัวหมุนทรงกระบอกอันหนึ่ง ที่เชื่อมต่อติดกับตัวหยุดนิ่งอันหนึ่ง
ส่วนหน่วยย่อย F1 จะยื่นออกมาในแมทริกซ์ มีขนาดเส้นผ่าศูนย์กลางประมาณ 10 นาโนเมตร และสูงประมาณ 8 นาโนเมตร เป็นกลุ่มพอลิเพปไทด์ที่มีเอนไซม์ ATP synthase หน่วยย่อยนี้ประกอบด้วยหน่วยย่อยอีก 6 หน่วย ได้แก่ หน่วยย่อยแอลฟาและหน่วยย่อยบีตา ชนิดละ 3 หน่วย
หน่วยย่อย Fo และ F1 เชื่อมต่อกัน ผ่านโปรตีนแกนกลางที่อยู่ภายใน ซึ่งมี 3 หน่วยย่อยได้แก่ 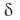 , , 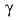 และ และ 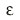 |
|
|
|
เอ...ยังมีอะไรที่เกิดจากการรวมตัวของโปรตีนหลายหน่วยย่อยอีกบ้างนะ
และโปรตีนแต่ละหน่วยย่อยนี้ยึดเหนี่ยวกันด้วยพันธะอะไร |
|
|
|


