เอนไซม์ส่วนใหญ่เป็นโปรตีนที่มีลักษณะเป็นก้อน (globular protein) อันเกิดจากการม้วนและทบของสายพอลิเพปไทด์ คล้ายกับเชือกที่ขดไปมา จนเกิดเป็นร่องและรูบนผิวของเอนไซม์ได้ โดยทั่วไปด้านในของโมเลกุลของเอนไซม์นั้น จะมีกรดอะมิโนที่มีคุณสมบัติไม่ชอบน้ำเป็นส่วนใหญ่ (hydrophobic amino acids) รวมกันอยู่ และส่วนมากกรดอะมิโนที่มีคุณสมบัติชอบน้ำ (hydrophilic amino acids) ซึ่งมีแขนงข้างเป็นหมู่ที่มีประจุหรือมีขั้ว จะอยู่บริเวณนอกๆ ของโมเลกุล ความสามารถในการทำงานของเอนไซม์จะขึ้นอยู่กับโครงรูปของเอนไซม์ (conformation) นี้เอง
โครงสร้างที่สำคัญของเอนไซม์ ได้แก่
![]() บริเวณเร่ง (active site)
บริเวณเร่ง (active site) ![]()
เป็นบริเวณหนึ่งที่อยู่บนผิวของโมเลกุลของเอนไซม์ที่มีลักษณะเป็นร่อง ที่เกิดจากการม้วนพับของสายพอลิเพปไทด์ ทำให้เกิดเป็นบริเวณที่สำคัญที่ทำให้เกิดปฏิกิริยา โดยภายในบริเวณเร่งนี้ จะมีบริเวณย่อยๆ อีกสองบริเวณคือ บริเวณจับและบริเวณเร่งปฏิกิริยา
![]() บริเวณจับซับสเตรตและผลิตภัณฑ์ (binding site)
บริเวณจับซับสเตรตและผลิตภัณฑ์ (binding site) ![]()
คือบริเวณที่ทำให้ซับสเตรตสามารถเข้ามาจับกับเอนไซม์ได้ดี
![]() บริเวณเร่งปฏิกิริยา (catalytic site)
บริเวณเร่งปฏิกิริยา (catalytic site) ![]()
เป็นบริเวณหนึ่งในบริเวณเร่ง ที่กรดอะมิโนที่อยู่บริเวณนั้นทำให้เกิดการเร่งปฏิกิริยาทั้งการสร้างพันธะและการแตกออกของพันธะ
![]() บริเวณอัลโลสเตอริก (allosteric site)
บริเวณอัลโลสเตอริก (allosteric site) ![]()
เป็นบริเวณหนึ่งบนผิวโมเลกุลของเอนไซม์บางชนิดที่ยอมให้โมเลกุลขนาดเล็กๆ ที่ไม่ใช่ซับเสตรตเข้าจับได้ และทำให้เกิดการเปลี่ยนแปลงรูปร่างของเอนไซม์ในบริเวณเร่ง แล้วอาจเกิดผลได้สองกรณีคือ ทำให้เร่งปฏิกิริยาได้ดีขึ้น หรือ เลวลง สำหรับโมเลกุลเล็กๆที่เข้ามาจับที่บริเวณอัลโลสเตอริกนี้ เรียกว่า ตัวแปลงปฏิกิริยา (modulator หรือ effector)
ตารางที่ 1 แสดงแขนงข้าง (R-group) ของกรดอะมิโนทั้ง 20 ชนิด
ชื่อกรดอะมิโน คุณสมบัติของแขนงข้าง |
รูปภาพ |
ไกลซีน(glycine) ไม่มีขั้ว แรงจับกันแบบอ่อนเช่น พันธะไฮโดรเจน (hydrogen bond) แรงไฮโดรโฟบิก (hydrophobic interaction) และแรงแวนเดอร์ วาลส์ (Van der Walls interaction) |
|
อะลานีน (alanine) ไม่มีขั้ว แรงจับเป็นแรงไฮโดรโฟบิก (hydrophobic interaction) และแรงแวนเดอร์ วาลส์ (Van der Walls interaction) มากกว่าอย่างอื่น |
|
วาลีน (valine) ไม่มีขั้ว แรงจับเป็นแบแรงไฮโดรโฟบิก (hydrophobic interaction) และแรงแวนเดอร์ วาลส์ (Van der Walls interaction) มากกว่าอย่างอื่น |
|
ลูซีน (leucine) ไม่มีขั้ว แรงจับเป็นแบบแรงไฮโดรโฟบิก (hydrophobic interaction) และแรงแวนเดอร์ วาลส์ (Van der Walls interaction) มากกว่าอย่างอื่น |
|
ไอโซลูซีน (isoleucine) ไม่มีขั้ว แรงจับเป็นแบบแรงไฮโดรโฟบิก (hydrophobic interaction) และแรงแวนเดอร์ วาลส์ (Van der Walls interaction) มากกว่าอย่างอื่น |
|
เฟนิลอะลานีน (phenylalanine) ไม่มีขั้ว แรงจับเป็นแรงไฮโดรโฟบิก (hydrophobic interaction) และแรงแวนเดอร์ วาลส์ (Van der Walls interaction) มากกว่าอย่างอื่น |
|
ทริปโตเฟน (tryptophan) มีขั้ว มีแรงจับกันแบบอ่อน เช่น พันธะไฮโดรเจน (hydrogen bond) แรงไฮโดรโฟบิก (hydrophobic interaction) และแรงแวนเดอร์ วาลส์ (Van der Walls interaction) |
|
ไทโรซีน (tyrosine) มีขั้ว เกิดพันธะไฮโดรเจน (hydrogen bond) |
|
ซิสเตอีน (cysteine) มีขั้ว เกิดพันธะไฮโดรเจน (hydrogen bond) |
|
เมไทโอนีน (methionine) มีขั้ว เกิดแรงจับกันแบบอ่อนเช่น พันธะไฮโดรเจน (hydrogen bond) แรงไฮโดรโฟบิก (hydrophobic interaction) และแรงแวนเดอร์ วาลส์ (Van der Walls interaction) |
|
กรดแอสพาติก (aspartic acid) มีขั้ว มีประจุ เกิดพันธะไฮโดรเจน (hydrogen bond) ได้ |
|
กรดกลูตามิค (glutamic aid) มีขั้ว มีประจุ เกิดพันธะไฮโดรเจน (hydrogen bond) ได้ |
|
ไลซีน (lysine) มีขั้ว มีประจุ เกิดพันธะไฮโดรเจน (hydrogen bond) ได้ |
|
อาร์จินีน (arginine) มีขั้ว มีประจุ เกิดพันธะไฮโดรเจน (hydrogen bond) ได้ |
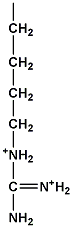 |
ฮีสติดีน (histidine) มีขั้ว มีประจุ เกิดพันธะไฮโดรเจน (hydrogen bond) ได้ |
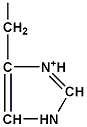 |
แอสพาราจีน (asparagine) มีขั้ว ไม่มีประจุ เกิดพันธะไฮโดรเจน (hydrogen bond) ได้ |
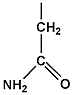 |
กลูตามีน (glutamine) มีขั้ว ไม่มีประจุ เกิดพันธะไฮโดรเจน (hydrogen bond) ได้ |
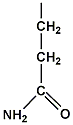 |
เซอรีน (serine) มีขั้ว ไม่มีประจุ เกิดพันธะไฮโดรเจน (hydrogen bond) ได้ |
|
ธรีโอนีน (threonine) มีขั้ว ไม่มีประจุ เกิด พันธะไฮโดรเจน (hydrogen bond) ได้ |
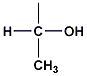 |
โปรลีน (proline) ไม่มีขั้ว แรงจับกันแบบอ่อน คือ แรงไฮโดรโฟบิก (hydrophobic interaction) และแรงแวนเดอร์ วาลส์ (Van der Walls interaction) มากกว่าอย่างอื่น |
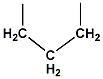 |
ตารางที่ 2 ไอออนโลหะที่ทำหน้าที่เป็นโคแฟคเตอร์สำหรับเอนไซม์
ไอออนโลหะของสารอนินทรีย์ |
ชื่อเอนไซม์ |
คิวปริก ( Cupric ) ( Cu 2+ ) |
ไซโตโครม ซี ออกซิเดส ( cytochrome c oxidase )
|
เฟอร์รัส ( ferrous: Fe 2+) หรือ เฟอร์ริก( ferric:Fe 3+ ) |
คะตะเลสที่มาจากวัว (bovine catalase) ไซโตโครม ซี เปอร์ออกซิเดส ( cytochrome c peroxidase )
|
โปแทสเซียมไออน ( K + ) |
ไพรูเวตไคเนส ( human pyruvate kinase: muscle )
|
แมกนีเซียมไออน( Mg 2+ ) |
เฮกโซไคเนส ( hexokinase ) กลูโคสซิกซ์ฟอสเฟต ( glucose-6-phosphatase ) ไพรูเวสไคเนส ( pyruvate kinase )
|
แมงกานีสไออน ( Mn 2+ ) |
อาร์จิเนส ( arginase ) ไรโบนิวคลีโอไทด์รีดักเทส ( ribonucleotide reductase )
|
โมลิบดินัมไออน( Mo )
|
ไดไนโตรจีเนส ( dinitrogenase ) |
นิเกิลไออน( Ni 2+ ) |
ยูีรีเอส ( urease )
|
ซีลีเนียม ไออน ( Se ) |
กลูตาไทโอน เปอร์ออกซิเดส ( glutathione peroxidase )
|
ซิงค์ไออน ( Zn 2+ ) (สังกะสี) |
คาร์บอนิกแอนไฮเดรส ( carbonic anhydrase ) แอลกอฮอล์ดีไฮโดรจีเนส ( alcohol dehydrogenase ) คาร์บอกซีเปปติเดส เอ และ บี (carboxypeptidase A & B)
|
(David L. Nelson and Michael M. Cox , Lehninger Principles of Biochemistry, 3rded., 2000, 245)
ตารางที่ 3 โคเอนไซม์ที่ทำหน้าที่เป็นตัวนำพาหมู่เคมี
โคเอนไซม์ |
หมู่เคมี |
สารต้นกำเนิดที่ได้รับจากอาหาร |
ไบโอไซติน ( Biocytin )
|
คาร์บอกซิลิก |
ไบโอติน ( Biotin )
|
โคเอนไซม์ เอ ( coenzyme A )
|
หมู่เอซิล |
กรดแพนโทเทนิค หรือ วิตามิน บี 5 และอนุพันธ์ |
5'- ดีออกซีอะดีโนซิลโคบาลามิน (โคเอนไซม์ บี 12, coenzyme B12 )
|
หมู่อัลคิลและ โมเลกุลของไฮโดรเจน
|
วิตามิน บี 12
|
ฟลาวินอะดีนีนไดนิวคลีโอไทด์ ( FAD )
|
อิเล็กตรอน |
ไรโบฟลาวิน หรือ วิตามิน บี 2
|
ลิโพเอต ( lipoate )
|
อิเล็กตรอนและหมู่เอซิล |
ไม่ต้องได้รับจากอาหาร |
นิโคตินาไมด์อะดีนีนไดนิวคลีโอไทด์ ( NAD+ )
|
ไฮไดรด์ไออน ( : H - ) |
กรดนิโคตินิค หรือ ไนอะซิน
|
ไพริดอกซาล ฟอสเฟต (pyridoxal phosphate)
|
หมู่อะมิโน
|
ไพริดอกซิน หรือ วิตามิน บี 6
|
เททระไฮโดรโฟเลต (tetrahydrofolate)
|
หมู่คาร์บอน 1 กลุ่ม |
วิตามินโฟเลท
|
ไธอามีน ไพโรฟอสเฟต ( thiamine pyrophosphate )
|
อัลดีไฮด์ |
ไธอามีน หรือ วิตามิน บี 1
|
(David L. Nelson and Michael M. Cox , Lehninger Principles of Biochemistry, 3rded., 2000, 245)
เอนไซม์บางชนิดหลังจากถูกถอดและแปลรหัสออกมาเป็นโปรตีนแล้ว ยังไม่สามารถทำงานได้ เนื่องจากยังอยู่ในรูป inactive form ต้องมีการเปลี่ยนแปลงโดยตัดบางส่วนออกเสียก่อน (modification) จึงจะทำงานได้ เอนไซม์กลุ่มนี้จึงถูกเรียกว่า ไซโมเจน (zymogen) หรือ โปรเอนไซม์ (proenzyme)
ตัวอย่างเช่น เอนไซม์ในระบบทางเดินอาหาร อาทิ เอนไซม์ย่อยโปรตีนที่ชื่อ ไคโมทริปซิน จะถูกหลั่งออกมาจากตับอ่อนในรูปของไคโมทริปซิโนเจน เอ แล้วจะถูกทริปซินตัดบางส่วนออกไป คือกรดอะมิโนในตำแหน่ง 14-25 และกรดอะมิโนในตำแหน่ง 147-148 ทำให้ได้ไคโมทริปซินที่สามารถทำงานได้
ตั้งแต่เริ่มมีการศึกษาเรื่องเอนไซม์กันเพิ่มมากขึ้นนั้น ก็ได้มีผู้เสนอสมมติฐานที่ใช้อธิบายว่าเอนไซม์สามารถจับกับซับสเตรตได้ดังนี้
สมมติฐาน "แม่กุญแจและลูกกุญแจ" (Fisher's 'Lock & Key' hypothesis)
ฟิชเชอร์ (Emil Fischer) ได้เสนอว่า การที่เอนไซม์จับกับซับสเตรตได้นั้น เนื่องมาจากความจำเพาะระหว่างโครงสร้างของเอนไซม์และซับสเตรตที่ทำให้มันจับกันได้พอดี เปรียบได้กับความพอดีระหว่างแม่กุญแจและลูกกุญแจ โดยให้แม่กุญแจแทนเอนไซม์และลูกกุญแจแทนซับสเตรต จากสมมติฐานนี้แสดงให้เห็นว่าเอนไซม์และซับสเตรตต้องมีรูปร่างที่ตายตัว ไม่สามารถเปลี่ยนแปลงได้เลย เพราะถ้าเอนไซม์หรือซับสเตรตเปลี่ยนแปลงไปแม้เพียงเล็กน้อย ก็จะไม่สามารถจับกันได้พอดี เหมือนการไขแม่กุญแจต้องใช้ลูกกุญแจของมันโดยเฉพาะเท่านั้น ใช้ลูกกุญแจอันอื่นที่มีรูปร่างใกล้เคียงกันก็ไม่ได้
แบบจำลองการจับกันของเอนไซม์กับซับสเตรส ตามสมมติฐาน Lock & Key
สมมติฐาน "การเหนี่ยวนำให้เหมาะสม" (Koshland 'Induce fit' hypothesis)
จากการศึกษาด้วยเทคนิคต่างๆ พบว่า โครงรูปของเอนไซม์หลังจากจับกับซับสเตรตแล้ว จะแตกต่างไปจากโครงรูปปกติ ฉะนั้นจึงมีความเป็นไปได้ว่า การจับของซับสเตรตจะไปเนี่ยวนำให้โครงรูปของเอนไซม์เปลี่ยนแปลงไป ทำให้กรดอะมิโนที่ทำให้หน้าที่เร่งปฏิริริยามาอยู่ในตำแหน่งที่เหมาะสมมากขึ้น สมมติฐานนี้เสนอโดย โคชแลนด์ (Daniel Koshland) เขาเสนอว่า " บริเวณเร่งของเอนไซม์น่าจะมีการเปลี่ยนแปลงรูปร่างเล็กน้อย เพื่อทำให้จับกับซับสเตรตได้ดีขึ้น หรือ ซับสเตรตอาจเปลี่ยนแปลงรูปร่างเพื่อทำให้ตัวมันจับกับบริเวณเร่งของเอนไซม์ได้ดีขึ้นก็ได้ หรือเกิดการเปลี่ยนแปลงทั้งคู่ก็ได้"
แบบจำลองการจับกันของเอนไซม์กับซับสเตรต ตามสมมติฐาน Induce fit
สมมติฐานแบบต่างๆนี้เป็นส่วนหนึ่งที่ใช้อธิบายในเรื่อง "เอนไซม์มีความจำเพาะด้วย" (บทที่ 4 เอนไซม์มีความจำเพาะ)